附属东方医院王飞龙、李强、郭忠良团队揭示衣康酸促进肺泡巨噬细胞介导的炎症反应,成果发表于《细胞代谢》
来源:医学院
时间:2025-07-07 浏览:
曾被广泛认为能“灭火”的衣康酸在肺部专属免疫细胞中反而“煽风点火”加重肺损伤。近日,同济大学附属东方医院呼吸与危重症医学科王飞龙、李强、郭忠良在《细胞代谢》(Cell Metabolism)在线发表题为“Itaconate promotes inflammatory responses in tissue-resident alveolar macrophages and exacerbates acute lung injury”的研究论文。研究团队系统评估了衣康酸对于组织驻留肺泡巨噬细胞(AMs)免疫功能的影响,发现不同于传统认为的抗炎作用,衣康酸在AMs上促进了LPS诱导的促炎细胞因子生成和NLRP3炎症小体激活。衣康酸预处理加重LPS诱导的肺组织损伤,而敲除ACOD1则可以显著提高急性肺损伤小鼠的生存率。

免疫细胞的代谢不仅为细胞提供能量,还对其免疫功能起着重要的调控作用,免疫和代谢的交互作用(免疫代谢)是过去20年中免疫生物学最重要的发现之一。其中,衣康酸及其免疫调节功能的发现是免疫代谢领域的一个范例。在内毒素(LPS)等刺激下,巨噬细胞显著上调乌头酸脱羧酶1(ACOD1,又称为IRG1)的表达,后者催化三羧酸循环中间产物顺乌头酸脱羧产生衣康酸。
大量研究发现,衣康酸可以显著抑制巨噬细胞中多种促炎细胞因子的生成和NLRP3炎症小体的激活,因此被广泛认为是一种抗炎代谢物。作为一种由巨噬细胞等免疫细胞在炎症状态下自身合成的代谢物,衣康酸对炎症性疾病的潜在治疗作用引起了科学界的广泛兴趣,至今为止有关衣康酸免疫调节作用和治疗效应的研究已有数百篇论文发表。但是,这些研究主要采用骨髓来源的巨噬细胞(BMDMs)或巨噬细胞系作为研究对象,衣康酸对于组织驻留巨噬细胞的免疫功能的影响尚不清楚。
研究人员首先发现,与BMDMs类似,原代AMs在LPS刺激下显著上调ACOD1基因和蛋白的表达,后者进一步介导了衣康酸的产生。但是,令人意外的是,衣康酸对BMDMs和AMs炎症反应的影响截然相反,在BMDMs上衣康酸抑制了LPS诱导的促炎细胞因子(IL-6和IL-12)的生成和NLRP3炎症小体的激活,但是在AMs上表现为剂量依赖性的促炎作用。
研究人员进一步检测了目前广泛使用的衣康酸衍生物(4-OI和DI)对于AMs免疫功能的影响,发现这些衍生物显著抑制了AMs介导的炎症反应,与天然衣康酸的作用相反。这一结果提示4-OI和DI可能并非通过在细胞内转化为天然衣康酸来起作用,而是通过其它靶点发挥生物学作用。因此,之前通过使用4-OI和DI而获得的研究结论可能不适用于天然衣康酸。
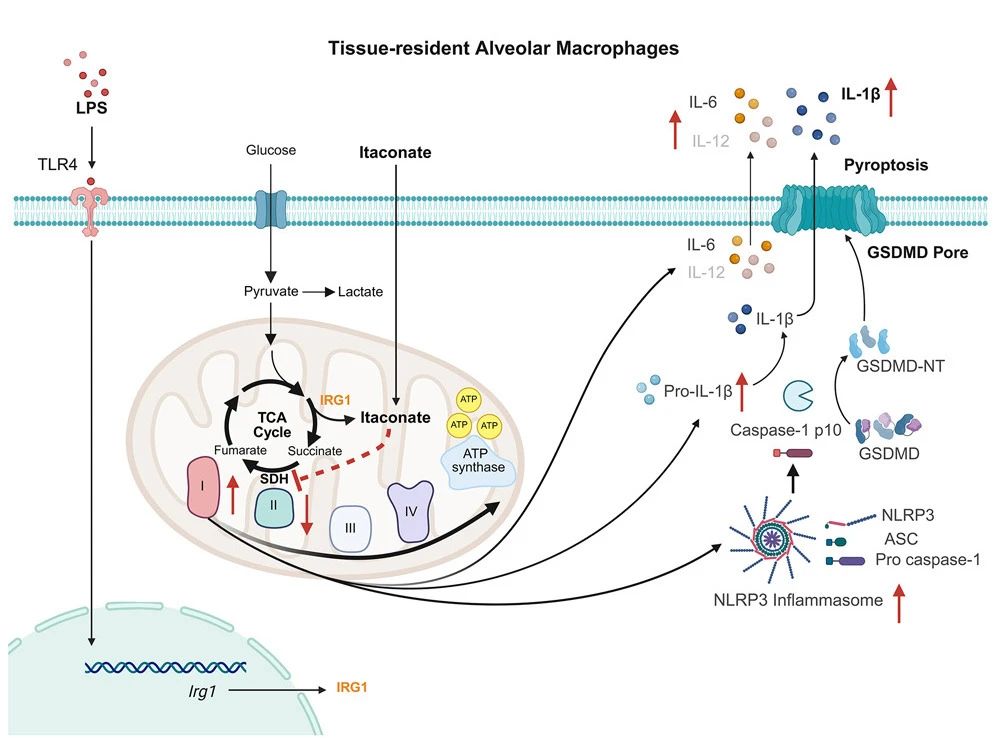
机理模式图(图源自Cell Metabolism)
研究人员接下来探索了天然衣康酸促进AMs炎症反应的机理。与来自骨髓的BMDMs不同,AMs主要起源于胚胎期的卵黄囊和胎肝造血祖细胞,之后在肺泡内通过自我更新维持AMs细胞池,而仅有少部分通过招募循环中的单核细胞进行补充,其所处的肺泡微环境与循环中的单核细胞以及体外培养的BMDMs有很大的区别。研究人员推测,衣康酸对AMs的促炎效应可能与肺泡的特殊微环境有关。为了验证这一猜想,研究人员将BMDMs移植到小鼠肺部,5天后通过流式将其分选出来,进行衣康酸预处理和NLRP3炎症小体诱导激活。有趣的是,移植后的BMDMs对于衣康酸的反应被完全逆转,从移植前炎症抑制转变为炎症水平上调,提示AMs对衣康酸的反应与其所处的肺泡微环境密切相关。进一步的机制研究发现,AMs在LPS刺激下发生的代谢重编程与BMDMs存在显著差异,其有氧糖酵解的水平并无显著升高,而仍然依赖于氧化磷酸化供能,这一代谢偏好可能与肺泡中极低的葡萄糖水平相关。而衣康酸抑制了琥珀酸脱氢酶(线粒体呼吸链复合体Ⅱ)的活性,导致AMs通过增强呼吸链复合体Ⅰ的活性来进行产能代偿,后者介导了NLRP3炎症小体的激活和促炎因子的产生。
研究人员进一步评估了衣康酸对于LPS诱导的急性肺损伤的影响,发现气道内衣康酸预处理增加了支气管肺泡灌洗液中的促炎细胞因子的生成水平,并显著加重肺组织损伤。急性肺损伤发病过程中,肺部有多种巨噬细胞参与了炎症反应,包括AMs、肺间质巨噬细胞和自循环招募的单核细胞分化而来的巨噬细胞。为了评估AMs是否介导了衣康酸加重肺组织损伤的效应,研究人员使用氯磷酸盐脂质体和CD11c.DTR小鼠两种方法来清除AMs,发现AMs清除后衣康酸的促进炎症反应和肺组织损伤的效应完全消失,证实了这些效应是通过促进AMs的炎症反应而产生的。与衣康酸的促炎作用相反,敲除ACOD1可以显著提高急性肺损伤小鼠的生存率。最后,研究人员评估了衣康酸对于人原代AMs炎症反应的影响,发现衣康酸预处理同样促进了人AMs中NLRP3炎症小体的激活。
综上所述,该研究发现衣康酸可促进AMs介导的炎症反应和肺组织损伤,而敲除ACOD1可以改善急性肺损伤小鼠的预后,为治疗急性肺损伤这一死亡率极高的呼吸危重症提供了新的思路。这一研究首次发现,衣康酸这一广受关注的免疫调节代谢物可以促进炎症因子的生成和NLRP3炎症小体的激活,挑战了衣康酸是一种抗炎代谢物的传统观点,提示其临床应用前需要更多的评估,尤其是对不同类型的组织驻留巨噬细胞免疫功能的调节作用。
同济大学附属东方医院呼吸与危重症医学科单梦田博士、罗志兵副主任医师、邓圣洁博士生和梅奥医学中心Song Zhang博士为论文共同第一作者,同济大学附属东方医院呼吸与危重症医学科王飞龙、李强和郭忠良教授为论文共同通讯作者。