生命之初,从一颗受精卵发育成一个复杂的多细胞生物体,是一个令人惊叹的精密过程。在这个过程中,表观遗传调控如同一位无形的“指挥家”,它不改变DNA序列本身,却通过一系列可遗传的化学修饰“标记”,精确地调控着基因何时、何地、以何种程度被表达,从而有序地引导着细胞命运的决定、谱系的分化与器官的形成。
近日,同济大学生命科学与技术学院高绍荣/刘晓雨教授团队在《细胞》系列综述期刊《遗传学趋势》(Trends in Genetics)上受邀发表题为“Epigenetic regulation in early embryo development: from zygotic genome activation to the first lineage specification”的综述。该综述系统梳理了哺乳动物着床前胚胎发育过程中表观遗传重编程的动态全景,重点阐述了DNA甲基化、组蛋白修饰、染色质高级结构、转座元件(TEs)和RNA修饰的调控作用,并深入探讨了体细胞核移植(SCNT,克隆技术)和辅助生殖技术(ART)中表观重编程异常所引发的胚胎发育障碍及其临床意义,为理解生命起源、提升生殖医学效率和开发新型治疗策略提供了重要理论框架。

近年来,单细胞多组学技术和低起始量表观基因组分析方法的突破,以前所未有的分辨率揭示了表观遗传重塑的时空动态。高绍荣/刘晓雨团队在综述中整合了来自小鼠模型以及人类胚胎等哺乳动物中的研究成果,总结了当前对早期胚胎发育过程中关键表观遗传动态的理解(见图1),对比了不同物种间的保守性和特异性,并特别关注了SCNT胚胎和ART胚胎中的异常模式。
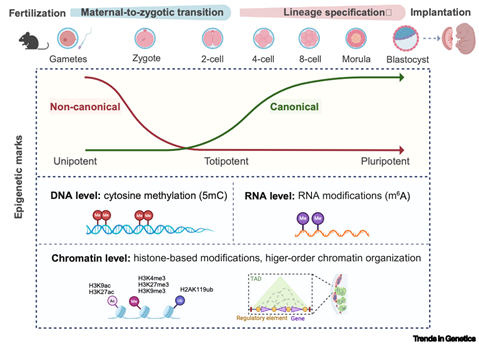
图1. 哺乳动物着床前胚胎发育过程中的表观遗传动态调控
DNA甲基化——不对称擦除与精准重建(见图2)
受精后,亲本基因组DNA甲基化经历不对称重编程,但最终都会在囊胚期达到整体低甲基化状态。印记控制区(ICRs)和一些年轻的转座元件(如L1PA)能逃避全局去甲基化,这对于维持等位基因特异性表达和基因组稳定性至关重要。囊胚期内细胞团(ICM)会由DNMT3A/B介导进行从头甲基化,建立类似体细胞的模式,而滋养层(TE)则保持相对低甲基化。
SCNT胚胎难以有效擦除供体细胞的高甲基化模式,导致胚胎基因组激活(ZGA)异常和发育停滞。临床中,印记区异常甲基化也会导致多种疾病的发生。ART操作、母体营养/环境因素等也被认为可能干扰正常甲基化维持,增加印记相关疾病风险。CRISPR/dCas9融合DNMT3A/3B/3L等工具可实现位点特异性甲基化编辑,在理论上为纠正印记缺陷提供了新策略,但脱靶效应和递送效率仍是临床转化的瓶颈。
组蛋白修饰——基因表达的精密开关与染色质状态的画笔(见图2)
在哺乳动物的早期胚胎发育过程中,核心组蛋白修饰经历了广泛的重编程。在配子和受精卵中,多种组蛋白修饰,例如H3K4me3、H3K27ac等,都会呈现一种非经典的分布模式,从而在全能性建立中发挥独特的调控功能。而H3K27me3、H3K9me3等抑制性的组蛋白修饰也在胚胎基因激活及转座子表达中起到关键的调控作用。
在对SCNT胚胎发育异常的研究中,组蛋白修饰的异常重编程是广泛存在的,H3K4me3、H3K427me3、H3K9me3以及H3K9ac等都被证明在SCNT胚胎中分布异常,并阻碍包括ZGA、谱系分化、印记调控等在内的多个生物学过程,通过联合相关组蛋白修饰酶的表达干预或抑制剂添加也在提高SCNT胚胎发育率上取得了显著效果。

图2. 小鼠和人类胚胎中物种特异性的表观修饰特征
染色质高级结构——基因组的三维“折叠艺术”
受精后,高度压缩的配子染色质经历解压缩,染色质相互作用减少。随后,基因组在三维空间上逐步组织化。拓扑关联结构域(TADs)和区室(Compartments A/B)开始形成:小鼠中在2-细胞期初现,8-细胞期成熟;人类中进程较慢,在囊胚期(尤其ICM内)才显著建立。人类TAD形成更依赖ZGA驱动的CTCF蛋白上调,而小鼠则与DNA复制更相关。核纤层关联域(LADs)也在小鼠早期胚胎中经历重塑,其强度在2-细胞期增强,并与活性区室(区室A)有非经典重叠。
供体细胞来源的TAD结构和粘连蛋白(Cohesin)是SCNT胚胎中染色质高级结构重编程的障碍。通过过表达 Kdm4d 去除H3K9me3或预耗竭供体细胞的Cohesin,可以促进ZGA并提高克隆效率。
转座元件(TEs)——从“基因组暗物质”到发育“多面手”(见图3)
曾被视为“垃圾DNA”的TEs(占灵长类基因组的~50%),在胚胎发育早期经历阶段特异性激活,这绝非偶然,而是扮演着多重关键角色(图3),包括作为顺势调控元件激活下游基因表达,产生嵌合转录本,重组染色质结构,驱动胎盘发育等。
SCNT胚胎中,难去除的体细胞异染色质导致本该在ZGA激活的TEs(如小鼠MT2, MERVL)表达延迟或不足。这种异常不仅发生在早期ZGA,也存在于谱系分化期(如小鼠囊胚期RLTR45-int异常),并与H3K9me3清除不完全密切相关。TE的异常表达可能部分解释了SCNT胚胎胎盘过大和发育失败的原因。
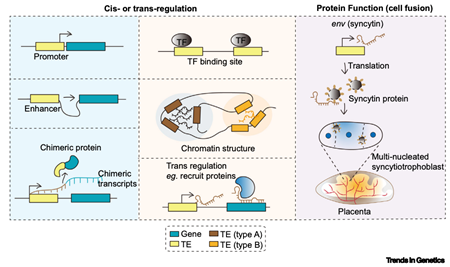
图3. 早期胚胎发育过程中转座元件(TEs)的调控功能
RNA修饰(m6A)——母源-合子转换的“计时器”
N⁶-甲基腺苷(m6A)是最丰富且研究最深入的RNA修饰。它在早期胚胎中动态变化,核心功能是协调母源-合子转换(MZT)。METTL3(核心甲基转移酶)等功能缺失会破坏这一平衡(如延迟降解2-细胞特异性转录本包括MERVL),导致胚胎阻滞在2-细胞期。
SCNT胚胎中,核重编程不完全导致RNA代谢失调。研究表明,m6A通路缺陷是SCNT胚胎发育能力低下的重要因素。除m6A外,其他RNA修饰(如5-甲基胞嘧啶 (5mC), 假尿嘧啶 (Ψ))在MZT中的作用也逐渐被认识,其动态可逆性、识别蛋白(Reader)和功能机制是未来研究热点。
协同与互作——表观层级的交响乐章
早期胚胎的表观重编程绝非各自为政,而是高度协同与互作的。作为最经典的组蛋白修饰组合,“二价染色质(Bivalent Chromatin)”(启动子区同时存在激活性的H3K4me3和抑制性的H3K27me3)在发育基因上富集,使基因处于“待命”状态,对谱系分化至关重要。DNA甲基化也会与组蛋白修饰协同调控某些区域(如印记区)的沉默或表达。TADs、区室、LADs的形成与特定的组蛋白修饰模式紧密关联。这种多层次的表观遗传网络共同构建了精确调控基因表达的时空环境。
综上所述,在胚胎发育过程中,表观修饰的有序重编程在一定程度上决定了细胞的命运和有序的谱系分化,近年来的技术进步推动了相关研究的快速进展,但仍有一些关键的问题没有解决。包括表观修饰的有序重编程是如何实现的;TEs以及RNA修饰等在转录调控中充当了怎样的角色;临床的表观遗传缺陷该如何纠正以及辅助生殖技术和环境因素如何通过表观遗传影响子代健康等。未来多组学数据的整合分析、新的单细胞测序手段的建立以及表观编辑技术等的进一步优化和应用有望为这些问题的解答提供新的思路,也进一步推动表观调控研究在临床上的应用。
同济大学生命科学与技术学院博士后徐睿敏、副教授李延鹤、副教授吴悠为论文的共同第一作者,同济大学高绍荣教授和刘晓雨教授为论文共同通讯作者。本研究获得了国家重点研发计划和国家自然科学基金等项目的支持。