张宇/高绍荣/王冕团队合作开发去材料化的光激活3D生物打印策略让细胞本身成为生物墨水,成果发表于《细胞》
来源:生命科学与技术学院
时间:2025-12-09 浏览:
12月8日,哈佛医学院张宇教授和同济大学高绍荣/王冕团队合作,在《细胞》(Cell)在线发表题为“Biomaterial-minimalistic photoactivated bioprinting of cell-dense tissues”的研究,提出了一条反向重构生物打印出发点的技术策略。该研究不再将细胞视为被动负载的生物成分,而是通过极低比例的分子连接手段,使活细胞在保持生物活性的同时,直接参与光交联与空间定域,建立了一种生理级细胞密度的去材料化光激活3D生物打印体系。

在生物打印领域,一个长期被默认接受的工程前提始终主导着技术路线:组织结构主要由外源材料提供,而细胞只是被嵌入其中的生物成分。水凝胶等支架材料通过赋予形态稳定性和可制造性,推动了3D生物打印的快速发展。然而,当研究目标从“是否能够打印”转向“是否真正具备组织功能”时,这一材料主导的逻辑逐渐显露出其结构性局限——细胞密度不可避免地被稀释,细胞连续性被打断,复杂组织功能难以自然形成。这一矛盾在干细胞相关应用中尤为突出。真实组织的形成高度依赖细胞之间的直接接触、精细的空间邻接关系以及协同自组织过程,而过度依赖外源支架往往会在提供机械稳定性的同时,干扰干细胞的命运决定与空间分化。尽管研究者不断尝试通过优化材料的力学性能、生物相容性和降解特性来改善细胞存活与分化表现,但在本质上,这一路径仍然让材料而非细胞掌握组织结构的主导权。
无支架或低支架生物打印被认为是实现高细胞密度、逼近体内组织状态的重要方向。诸如细胞团堆叠、自组织融合等策略在一定程度上突破了水凝胶比例限制,但其空间分辨率通常受限于百微米量级,在复杂三维几何结构、内部通道构建以及批次一致性方面仍存在明显不足。这使得相关方法在构建高可重复、高结构保真度的体外组织模型时,难以满足器官级研究与工程化应用的要求。
能力边界被重新定义:密度、尺度与结构自由度
该研究的技术关键,在于它将“交联反应”的发生位点,从传统的水凝胶骨架,转移到了细胞膜界面。研究者利用氧化并甲基丙烯酰化的透明质酸(OMHA)作为分子连接体,使其在温和条件下与细胞膜表面的氨基发生反应,从而在细胞表面引入可光交联基团。当暴露于可控波长的光照后,相邻细胞之间直接形成交联网络,实现整体固化,而无需任何支架材料(图1)。这一设计,解决了光固化DLP生物打印长期面临的一项核心瓶颈。传统光固化DLP打印高度依赖可交联材料,以保证成形精度和结构稳定性,但高细胞密度会引起严重光散射和交联失败。而活细胞墨水(CLINK)体系中的交联反应发生在细胞界面,使打印能够在~109 cells/mL级别的超高细胞密度下仍保持良好的分辨率与成形能力,首次将DLP技术推入“近乎纯细胞打印”的区间。这种高度致密的起始状态,使构建体在形成之初便具备类似原生组织的细胞接触环境,也为后续组织成熟与功能建立提供了更贴近体内条件的出发点。
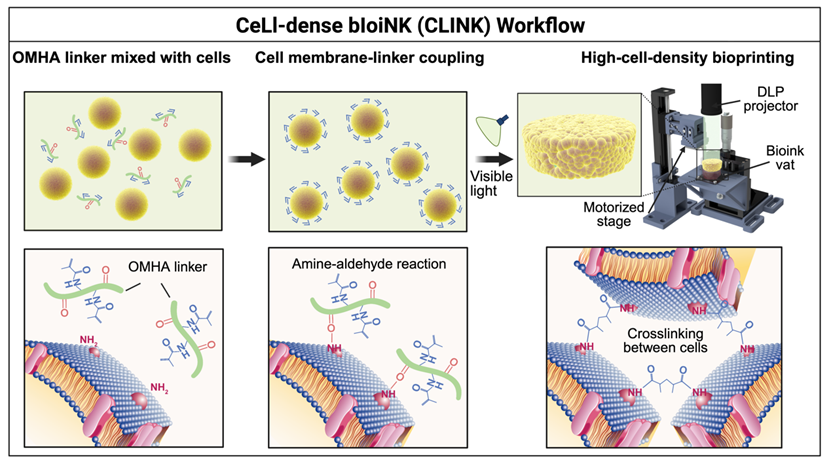
图1.活细胞墨水(CLINK)体系的建立流程
此外,这种细胞的修饰不会影响细胞的活性与功能,例如,胚胎干细胞的三胚层分化能力在修饰前后基本上没有变化(图2)。在工程能力层面,这一策略显著拓展了生物打印的边界。借助DLP的高空间分辨率,研究者可在极短的单层曝光时间内完成复杂结构的稳定成型。实验结果表明,该系统不仅能够实现~200 μm特征尺寸的高分辨平面结构,还可直接打印具有分支管道与空腔结构的三维纯细胞组织,并保持良好的结构连通性与可灌注性。这使纯细胞构建首次具备了复杂组织拓扑结构的工程可设计性,而不再局限于简单细胞团或自组织聚集体。
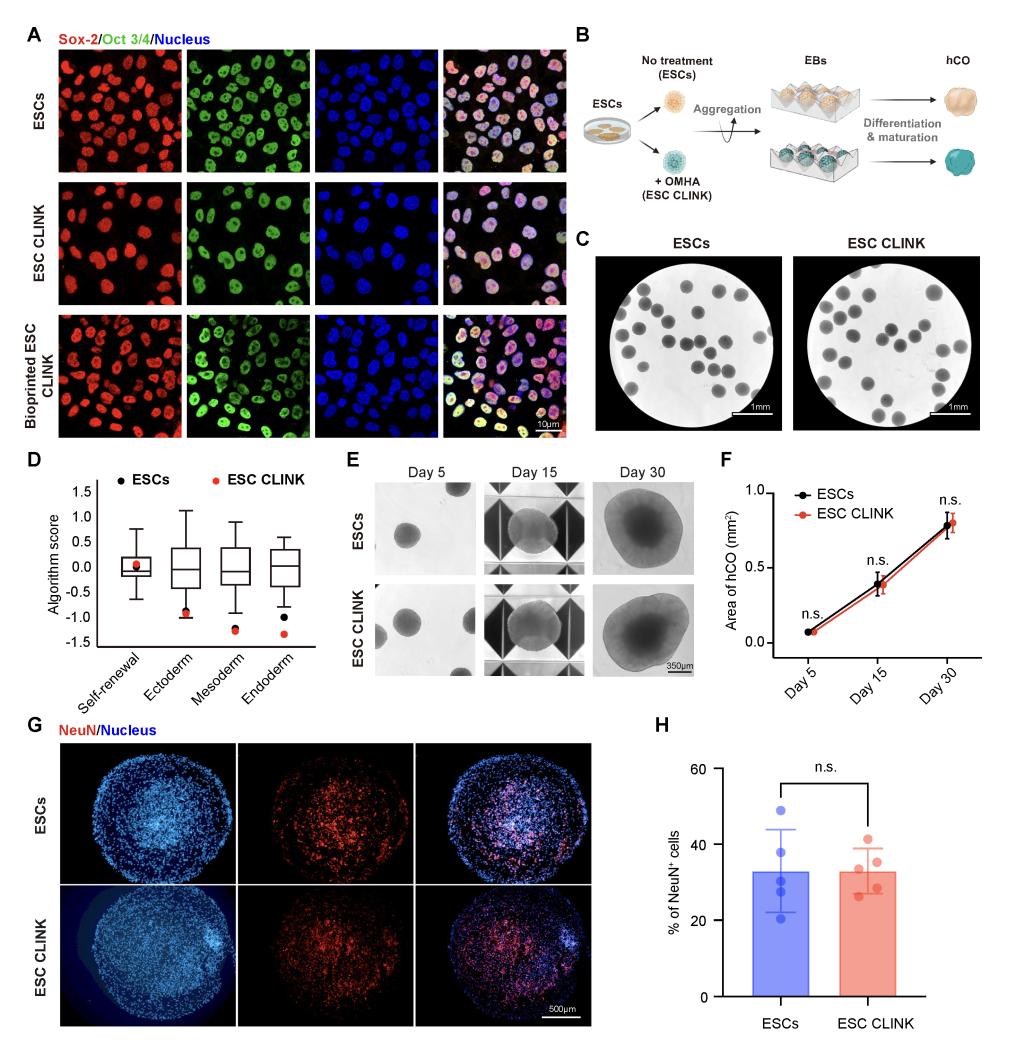
图2.胚胎干细胞- CLINK打印后功能评价
功能不是被诱导,而是在可控条件下自然出现
在功能层面,该去材料化打印平台的优势尤为突出,特别体现在对高度依赖细胞耦合行为的组织模型中。在神经系统模型中,基于干细胞来源的皮层神经元和运动神经元以超高密度被精确打印至预设区域,仅7天内即可形成明确的跨区域轴突投射。通过光遗传刺激与多电极阵列记录,研究者验证了稳定、可重复的功能性神经环路建立(图3A)。相比传统类器官方法通常需要30-80天才能形成可检测的连接结构,该体系在时间尺度与结构一致性上均实现显著压缩。在心脏模型中,研究者利用iPSC衍生心肌细胞快速打印构建带腔室的三维CardioChamber结构,每4分钟即可批量构建约90个几何一致的构建体(图3B)。这些构建体在培养2天内即出现同步收缩,并在第7天表现出稳定、可重复的节律性搏动,其功能特征通过钙离子瞬变成像得到了定量验证。
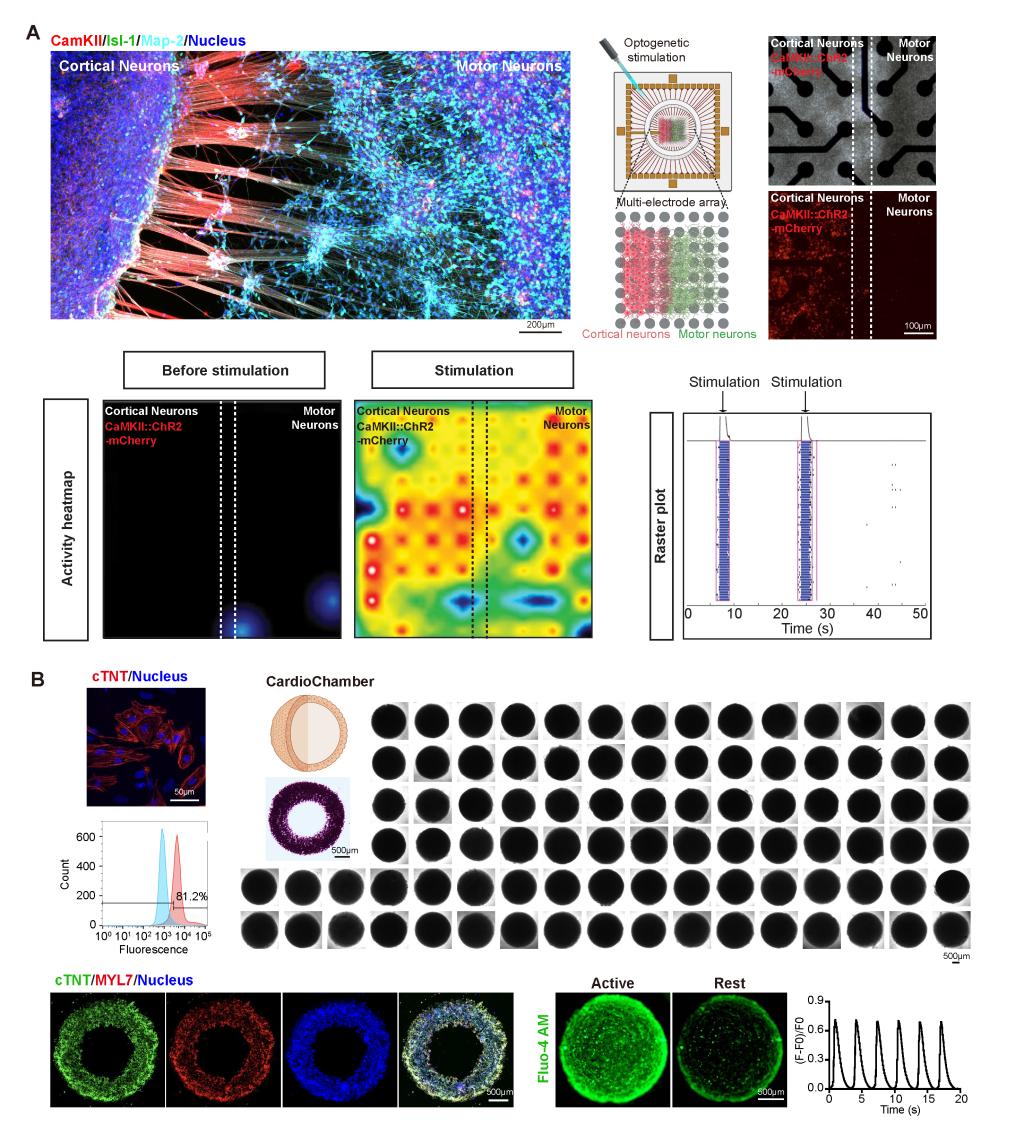
图3.纯细胞神经环路和三维心脏(CardioChamber)的结构和功能
体内验证:可设计结构促进再生整合
进一步地,该纯细胞打印策略的生物学有效性在体内再生场景中得到了验证。在肝组织模型中,研究者打印构建了细胞密度约109 cells/mL的肝样组织,并引入可灌注管道结构。与传统GelMA构建体(细胞密度约 8×106 cells/mL)相比,纯细胞构建体在体内移植后表现出更高的CYP3A4活性、更显著的新生血管化(CD31 表达明显升高),并在血清中检测到稳定的人源白蛋白分泌(图4A)。在皮肤缺损模型中,高密度MSC/EC纯细胞打印结构显著加快创面修复进程:术后第7天伤口闭合率达到约82%,显著优于对照组,并伴随更有效的再上皮化、血管生成及毛囊再生(图4B)。这表明,空间可设计的纯细胞结构不仅能够存活,更能主动参与组织重塑过程。
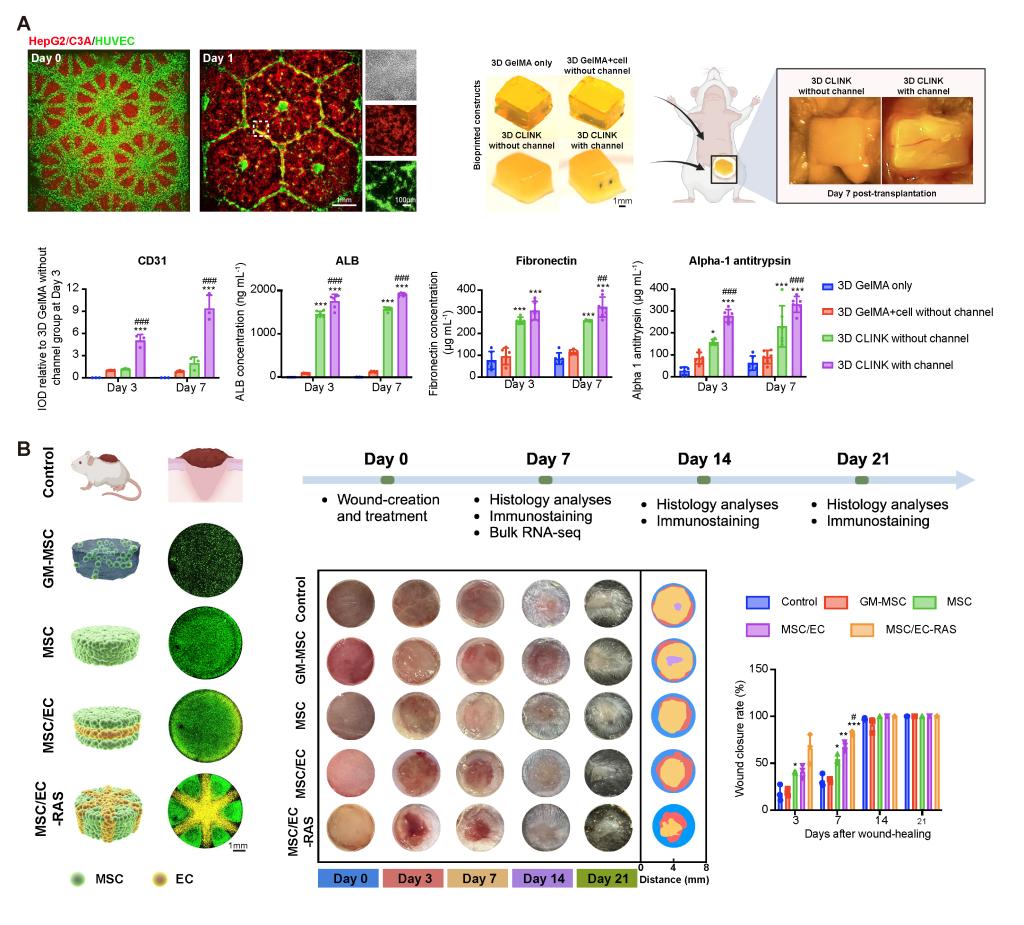
图4.高细胞密度带管道肝脏具有更好肝脏功能及分层组织促进皮肤的再生修复
值得指出的是,这是Cell期刊首次发表3D生物打印领域的研究性论文,这项工作通过赋予活细胞以结构构建能力,确立了一条区别于传统材料驱动范式的生物打印新路径。该策略将超高细胞密度、精确空间组织以及快速、可重复的制造过程相结合,使完全由体细胞或干细胞衍生细胞构成的高内涵组织构建成为可能。更重要的是,这一生物打印平台为构建新一代功能性生物微组织与人源体外模型提供了稳健而通用的工程基础,使相关研究有望超越概念验证阶段,在组织修复、疾病建模、器官芯片以及替代动物实验等多个生物医学场景中展现切实的应用潜力。
哈佛医学院张宇教授为论文通讯作者,同济大学王冕研究员、上海交通大学李婉露助理教授、上海交通大学郝晋助理研究员、哈佛医学院蔡玲博士为论文并列第一作者。该研究得到同济大学高绍荣院士、同济大学东方医院刘中民教授、哈佛干细胞研究所Kevin Eggan教授和梅奥医学中心Alfredo Quinones-Hinojosa主任的指导及支持。
论文链接:https://www.sciencedirect.com/science/article/abs/pii/S009286742501308X?dgcid=author