生命科学与技术学院高绍荣团队在《细胞·干细胞》上发表论文,揭示人胚胎干细胞全能性调控新机制
来源:生命科学与技术学院
时间:2025-10-30 浏览:
在哺乳动物的早期胚胎发育中,生命的最初一次“自我发声”来自合子基因组激活(Zygotic Genome Activation, ZGA)——这是细胞命运最早的分水岭。随着ZGA的启动,胚胎从母源转录控制转向自主转录,细胞也从全能性状态(totipotent state)逐步过渡到naïve多能性状态(naïve pluripotent state)再到primed多能性状态(primed pluripotent state),这一转变不仅奠定了发育轨迹,也为体外干细胞模型的构建提供了蓝图。
在这一过程中,重复序列(repeats)——尤其是长末端重复元件(LTR)——的激活与沉默构成了发育程序的隐秘节奏。它们既是全能性状态的标志,也是表观调控的靶点。BioArt曾报道高绍荣团队发现,组蛋白H3K9me3修饰的建立对于维持LTR的沉默至关重要,而RNA层面的修饰,尤其是m⁶A(N6-甲基腺苷),也通过与染色质因子的对话参与其中。例如,在小鼠胚胎干细胞中,m⁶A reader蛋白YTHDC1可通过招募KAP1促进H3K9me3的沉默性修饰,缺失YTHDC1则导致LTR去抑制和细胞重编程为全能态。然而,这一RNA修饰—染色质互作网络在人类胚胎干细胞中的作用机制仍不清楚。
10月29日,同济大学高绍荣教授、高亚威教授、王译萱教授,北京大学刘君教授团队合作在《细胞·干细胞》(Cell Stem Cell)上发表研究论文,题为“N6-methyladenosine on L1PA Governs the Trans-silencing of LTRs and Restrains totipotency in Naïve Human Embryonic Stem Cells”。该研究揭示了m⁶A修饰通过L1PA RNA介导的跨层级转录调控网络,调控LTR沉默并限制人类胚胎干细胞的全能性,阐明了RNA修饰与染色质重塑之间的分子连接机制。

研究者在naïve人胚胎干细胞中使用METTL3抑制剂降低m⁶A水平,发现细胞增殖减缓、naïve与primed标志基因下调,而8-细胞期特征基因显著上调。在诱导体系中,METTL3抑制阻断了naïve向primed的分化,却促进其向8C-like全能态转变。嵌合实验进一步显示,m⁶A缺失增强了细胞对滋养外胚层的嵌合能力,提示m⁶A抑制拓展了发育潜能。转录组和单细胞分析显示,METTL3抑制后细胞转录谱更接近8C胚胎,上调的LTR主要集中于ERV1与ERVL-MaLR亚家族,表明m⁶A抑制促进了广泛的全能性转录激活。
进一步的nascent RNA-seq与ATAC-seq显示,8C基因、eRNA和LTR的转录活性与染色质开放度显著上升。联合N-ChIP结果揭示,不同LTR亚家族呈现差异化表观调控模式:ERV1激活伴随H3K27ac增强,而ERVL-MaLR激活则伴随H3K9me3丢失。m⁶A-seq结果显示,修饰下降区域主要集中在eRNA和L1PA上,其中8C eRNA上m⁶A的丢失促进了EP300结合与H3K27ac积累,而L1PA上m⁶A的去除复现了METTL3抑制的转录组特征。利用FTO-dCas13b系统定点擦除L1PA上的m⁶A得到一致结果,确立L1PA是关键的m⁶A靶点。
ChIRP-seq结果显示,L1PA RNA富集于增强子及上调的8C LTR区域,可直接结合LTR并招募表观因子。m⁶A丢失后,L1PA与H3K27ac写入酶EP300的结合增强,而与H3K9me3调控因子KAP1的结合减弱。研究者据此提出,m⁶A作为“组蛋白修饰调控因子选择器”(selector),决定L1PA招募的表观因子类型:在ERVL-MaLR区域,m⁶A保证KAP1招募并维持H3K9me3沉默;而在ERV1区域,m⁶A阻止EP300结合、抑制H3K27ac激活。此外,eRNA亦为L1PA的结合靶点,其转录受m⁶A直接修饰的顺式调控与L1PA脚手架介导的反式调控协同调节。
基于上述结果,研究团队提出了一个整体模型:在人类naïve胚胎干细胞中,METTL3抑制导致m⁶A水平下降,从而激活8C特异性转录本并引发染色质重塑。m⁶A修饰的丢失主要集中于eRNA与L1PA上,通过顺式调控和反式调控两种机制共同影响染色质状态及转录活性。其中,L1PA RNA作为跨层级的分子支架,能结合eRNA与LTR区域并招募表观因子:带有m⁶A的L1PA招募KAP1并限制EP300,从而维持LTR的抑制状态;当m⁶A丢失后,EP300结合增强促使ERV1获得H3K27ac,KAP1结合减少促使ERVL-MaLR失去H3K9me3,最终推动8C LTR激活和8C-like转录状态形成。
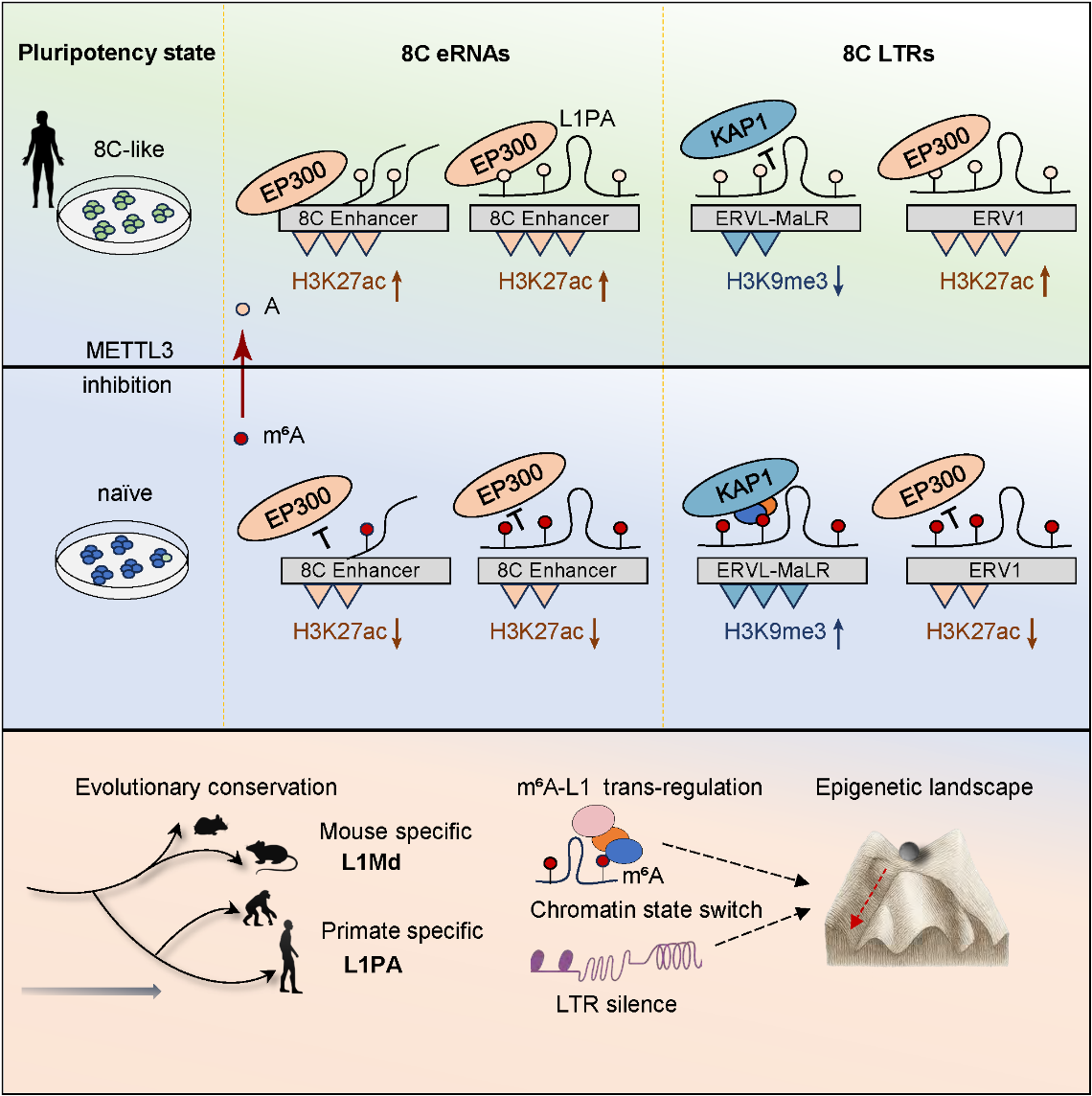
总体而言,该研究揭示了一个贯穿DNA、RNA与染色质的层级调控网络——m⁶A–L1PA–LTR轴作为RNA修饰与表观重塑之间的关键桥梁,阐明了人类胚胎干细胞由多能性向全能性转变的分子机制。这项工作不仅深化了我们对早期发育中RNA修饰生物学功能的理解,也提供了RNA介导染色质可塑性的全新视角。未来,这一机制有望为细胞命运重编程与干细胞状态调控提供新的理论基础与干预策略。
同济大学生命科学与技术学院博士研究生朱学昊、常展赫,北京大学生命科学学院博士研究生肖维德为论文共同第一作者;同济大学高亚威教授、高绍荣教授、王译萱教授,北京大学刘君教授为论文共同通讯作者。
论文链接:https://doi.org/10.1016/j.stem.2025.10.003