附属第十人民医院彭文辉团队首次揭示左心疾病相关性肺动脉高压中肺静脉重构-Treg细胞调控新机制,成果发表于《循环研究》
来源:医学院
时间:2025-04-23 浏览:
左心疾病相关肺动脉高压(PH-LHD)是肺动脉高压最常见的类型,目前治疗策略仍然以原发心脏病治疗为主,肺动脉高压靶向药物治疗效果存在争议。肺静脉重构是PH-LHD最重要的病理改变之一,调节性T(Treg)细胞在维系肺血管免疫稳态中发挥着重要作用,但Treg细胞对肺静脉重构及对PH-LHD的作用和机制尚不清楚。
4月16日,同济大学附属第十人民医院心血管内科彭文辉教授团队在心血管领域著名期刊《循环研究》(Circulation Research)杂志在线发表题为“Treg Cells Attenuate Pulmonary Venous Remodeling in PH-LHD via NLRC3 Signaling”的研究论文。该研究首次发现PH-LHD肺静脉周Treg细胞显著聚集,并揭示PH-LHD中Treg细胞抑制肺静脉重构的作用被显著削弱,其关键机制为Treg细胞中NLRC3通过调控IL-18的分泌抑制肺静脉内皮间质转化(EndMT),该研究有助于深入理解PH-LHD的致病机制,还为治疗该疾病提供了新的思路和干预靶点。

研究发现,天然免疫蛋白NLRC3基因敲除促进PH-LHD的疾病进展,主要是由于NLRC3基因缺失削弱了Treg细胞的增殖、免疫抑制和对肺静脉EndMT和重构的抑制作用(图1)。
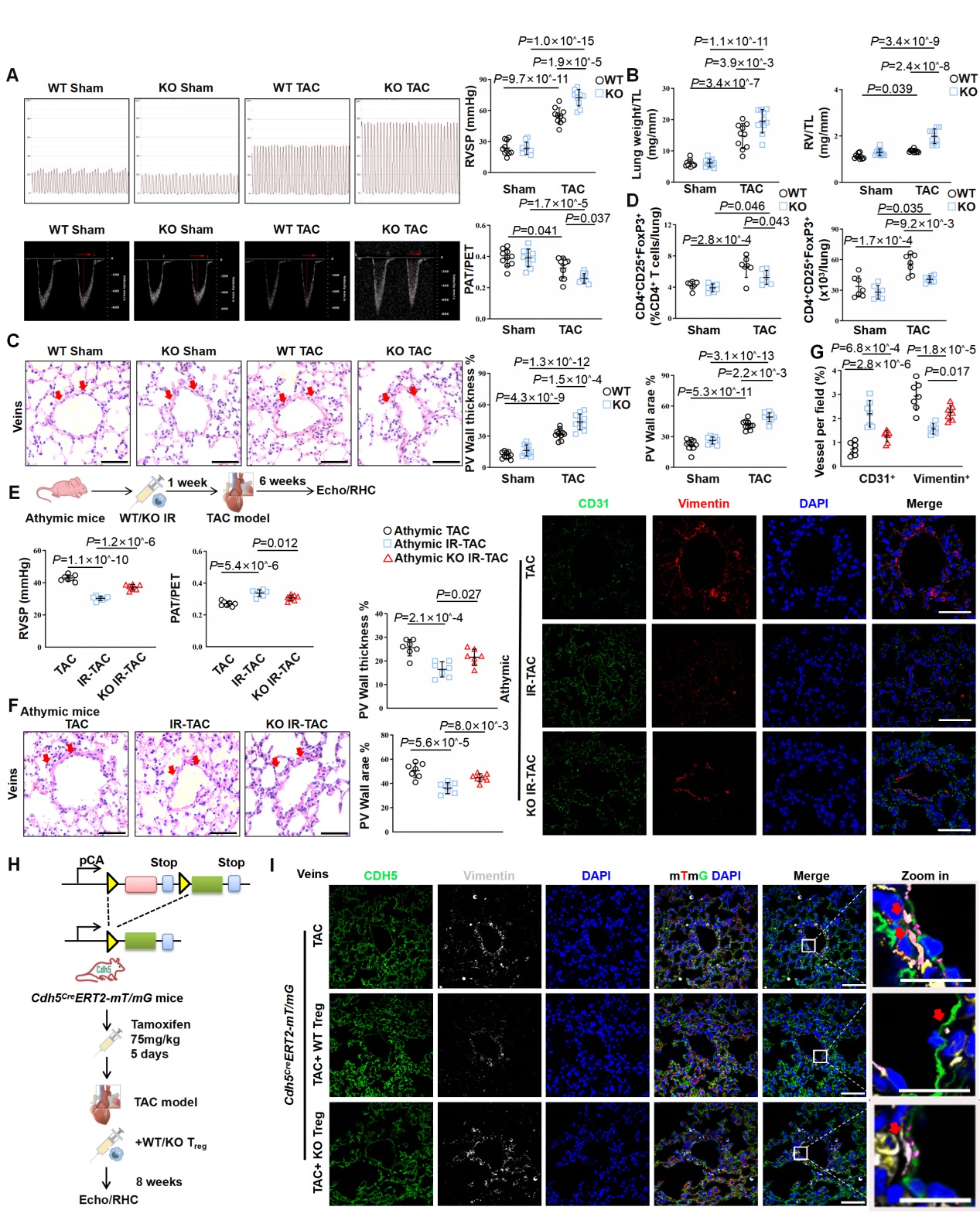
图1. NLRC3基因敲除削弱了Treg细胞对肺静脉EndMT和肺静脉重塑的保护功能。A-D: WT和KO小鼠TAC术后的血流动力学、肺静脉H&E染色、Treg细胞定量分析;E-G: 免疫缺陷小鼠TAC术后免疫重建(移植WT/KO Treg细胞)的血流动力学、肺静脉H&E染色以及肺组织免疫荧光;H-I: Cdh5CreERT2-mT/mG内皮细胞谱系示踪小鼠模型构建及输注WT/KO Treg细胞后的肺静脉免疫荧光染色。
进一步研究发现,Treg细胞调节肺静脉EndMT的关键机制:NLRC3调控Treg细胞中的细胞因子IL-18的分泌,介导内皮细胞中受体酪氨酸激酶信号影响EndMT进程(图2)。
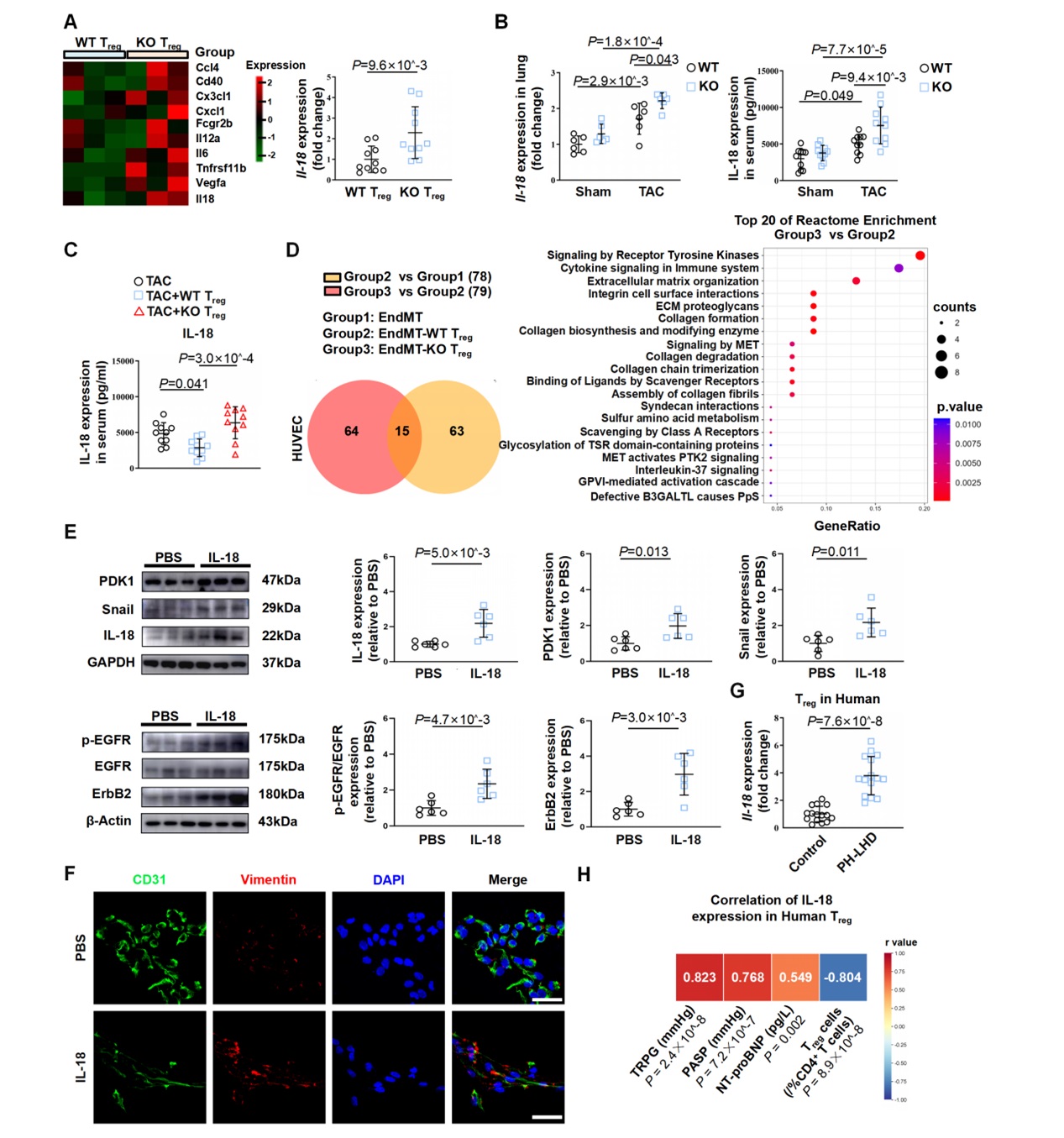
图2. NLRC3-/-Treg细胞通过介导IL-18分泌调控EndMT。A:WT与KO Treg细胞差异基因热图及IL-18 mRNA表达;B-C:WT/KO TAC小鼠、移植WT/KO Treg细胞的TAC小鼠血清IL-18检测结果;D:与WT/KO Treg细胞共培养的内皮细胞差异基因和富集信号通路分析;E-F:IL-18激活对内皮细胞下游RTK通路及EndMT的影响;G-H:PH-LHD患者外周血Treg细胞中IL-18表达的相关性分析。
综上所述,该研究聚焦肺静脉重构在肺动脉高压中的关键病理改变,在TAC所诱导的PH-LHD小鼠肺静脉周观察到Treg细胞的早期聚集,且肺静脉重构呈现典型的内皮间质转化的病理特征;其致病机制主要为Treg细胞通过NLRC3/IL-18信号轴发挥抑制肺静脉内皮损伤和内皮间质转化的作用;NLRC3的表达水平则与PH-LHD的疾病不良参数密切相关,并揭示IL-18结合蛋白的治疗潜力,提供了一种有前景的诊断和治疗策略(图3)。

图3.机制图
同济大学附属第十人民医院心血管内科彭文辉教授、泛血管研究所俞晴助理研究员为论文共同通讯作者。同济大学医学院硕士研究生古丽妮戈尔、博士研究生曾彦熹和博士研究生鄂光熙为论文共同第一作者。该研究获得了国家自然科学基金项目、心脏病全国重点实验室开放课题、西藏自然科学基金等项目资助。该研究的开展还得到了同济大学医学院章小清教授和四川省人民医院曹云山教授的指导和支持。
彭文辉课题组致力于泛血管疾病(动脉粥样硬化性疾病、心肌梗死、肺动脉高压)的综合诊治及其发病新机制的研发工作。近5年来,该团队在Circulation Research (2025)、Advanced Science (2025)、Cell Death Differ (2024)、Nat Comm (2022/2019)等国际知名期刊上发表系列研究工作。
论文链接:https://www.ahajournals.org/doi/10.1161/CIRCRESAHA.124.325201