生命科学与技术学院余勇/江赐忠团队揭示Bcl11a调控造血干细胞衰老的双重机制,成果发表于《科学·免疫学》
来源:生命科学与技术学院
时间:2025-04-14 浏览:
近日,生命科学与技术学院余勇教授团队与江赐忠教授团队合作,在《科学·免疫学》(Science Immunology)发表题为“Bcl11a maintains hematopoietic stem cell function but accelerates inflammation-driven exhaustion during aging”的研究成果。该研究通过创新性构建诱导型Bcl11a嵌合小鼠模型,结合多组学测序与功能验证,首次系统解析了转录因子Bcl11a在造血干细胞(HSC)稳态与衰老进程中的双重调控机制,为血液系统衰老干预提供了重要理论突破。

随着年龄增长,造血干细胞(HSC)功能衰退,导致血液和免疫系统功能下降,但其具体机制一直是个谜。研究团队发现,随着年龄增长,HSC中Bcl11a的表达水平显著上升。为深入研究其功能,团队构建了一种特殊的嵌合小鼠模型,能够在特定条件下诱导Bcl11a过表达。通过竞争性移植实验和免疫荧光染色技术,团队在同一骨髓微环境中对比了Bcl11a过表达HSCs与正常HSCs的功能。结果表明,Bcl11a过表达不仅显著增强了HSCs的造血能力,还延缓了其衰老进程,而与之共存的正常HSCs则表现出明显的功能退化。
为揭示Bcl11a的作用机制,研究团队运用先进的CUT&Tag技术绘制了Bcl11a全基因组结合图谱,并整合了转录组(RNA-Seq)及染色质可及性(ATAC-Seq)数据分析。研究发现Bcl11a能够特异性抑制Fc受体信号通路中的关键基因Fcer1g。进一步的功能实验证实,Fcer1g信号通路的激活会触发HSCs内炎症相关网络的活化,导致干细胞分化加速和自我更新能力受损。这一发现揭示了Bcl11a通过抑制Fcer1g来维持HSCs静息态的核心机制,从而在造血稳态及应激条件下有效增强HSCs功能,延缓衰老相关的功能衰退。
然而,研究团队发现Bcl11a过表达在衰老过程中呈现“双刃剑”效应:在增强HSCs功能的同时,显著促进了骨髓髓系细胞的异常增殖,导致骨髓微环境中IL-1β水平持续升高。这种慢性炎症状态通过激活正常HSCs表面的Fc受体,最终引发干细胞功能耗竭。团队通过使用IL-1β受体拮抗剂或敲除Fcer1g基因,成功逆转了HSCs的功能衰退,证实IL-1β-Fcer1g轴是介导HSCs非自主性耗竭的核心分子通路。
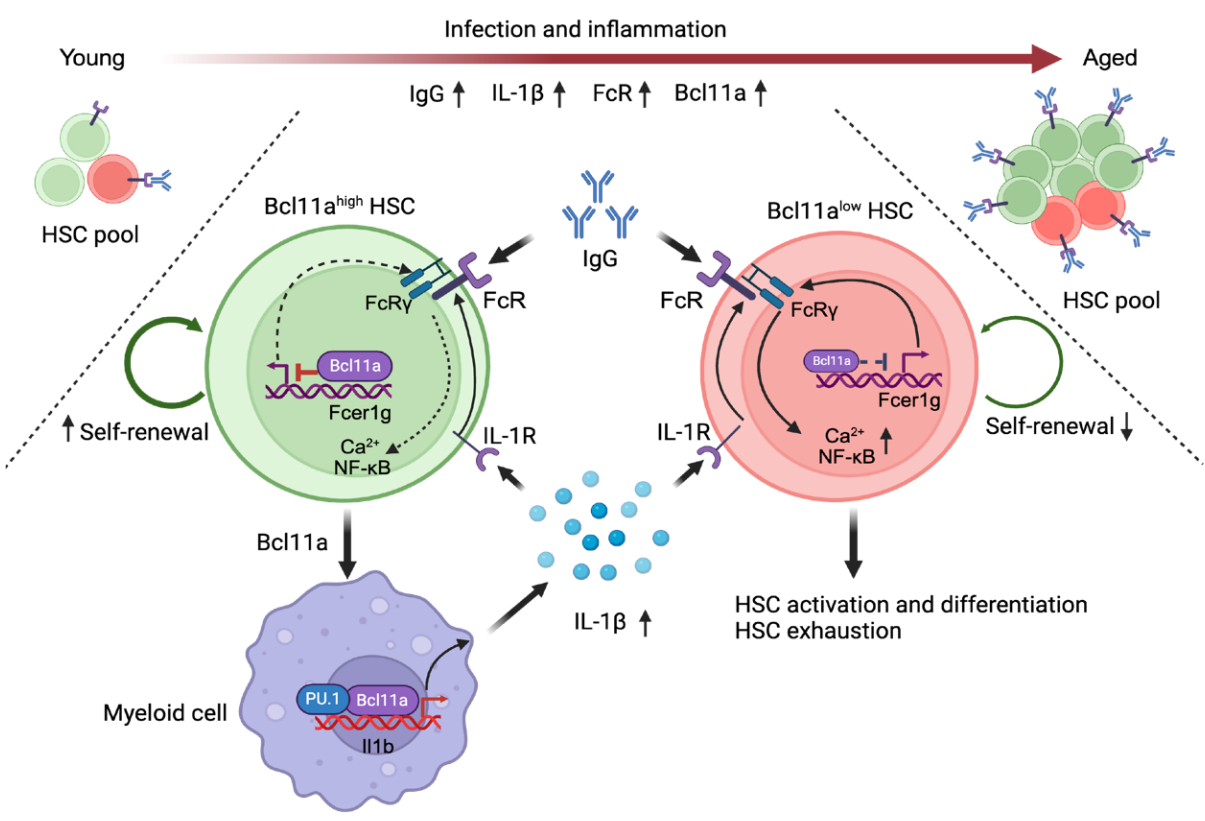
该研究首次阐明了Bcl11a在HSC衰老中的双重调控机制:一方面通过维持HSC静息态抵抗内源性衰老,另一方面却通过诱导炎症微环境加速外源性耗竭。该研究不仅加深了我们对HSCs衰老机制的理解,还为延缓衰老相关的血液系统疾病(如免疫力下降、血液肿瘤风险增加等)提供了新的潜在靶点。
同济大学生命科学与技术学院余勇教授、江赐忠教授为论文共同通讯作者。同济大学生命科学与技术学院王晶博士、张林林博士研究生、崔昕宇博士、徐香博士研究生为论文共同第一作者。该研究得到了同济大学高绍荣教授、梁爱斌教授和香港大学刘澎涛教授的大力支持与帮助。
论文链接:https://www.science.org/doi/10.1126/sciimmunol.adr2041