化学科学与工程学院徐涛课题组利用卤原子转移策略实现手性α-CF3炔烃的高效构建,研究成果发表于《德国应用化学》
来源:化学科学与工程学院
时间:2024-04-16 浏览:
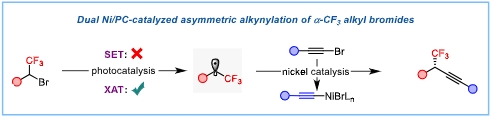
手性α-CF3炔烃化是一类非常重要的合成,CF3基团的引入能够极大改变分子的生物活性。炔基有丰富的官能团转化潜力,且可以作为“点击化学”的把手,因此,炔烃化是快速构建先导化合物库的重要方式。三维立体结构因为能够有效契合生物体的手性环境,在化学合成、药物开发等领域有着独特而显著的作用。但由于缺乏有效的合成方法,该类化合物的构建面临着很大的挑战,这也限制了其在合成化学中的应用。基于利用手性化合物的立体专一性的成键途径已有报道,相对而言,实现其不对称催化合成具有明显的优势和价值。近日,同济大学化学科学与工程学院徐涛教授课题组利用卤原子转移策略实现手性α-CF3炔烃高效构建的新方法,相关研究成果以“Halogen-Atom Transfer Enabled Catalytic Enantioselective Coupling to Chiral Trifluoromethylated Alkynes via Dual Nickel and Photocatalysis”为题在线发表于化学领域著名国际学术期刊《德国应用化学》(Angewandte Chemie International Edition)。

近年来,徐涛教授课题组围绕光镍双催化的不对称还原偶联已经发展了多个不对称偶联反应,相关研究工作大多是通过单电子转移策略实现的烷基卤化物还原产生关键的烷基自由基中间体。而对于手性α-CF3炔烃合成中需要涉及的α-溴代三氟甲基化合物来说,其还原电位较低,已经超过了光催化体系的还原能力范围,因此无法通过上述策略来实现其还原过程。为此,研究团队借助卤素原子转移策略,顺利解决了这一极具挑战的关键科学难题,这也是镍催化烷基卤化物的不对称还原偶联反应中首次利用卤素原子转移策略实现的成键过程。
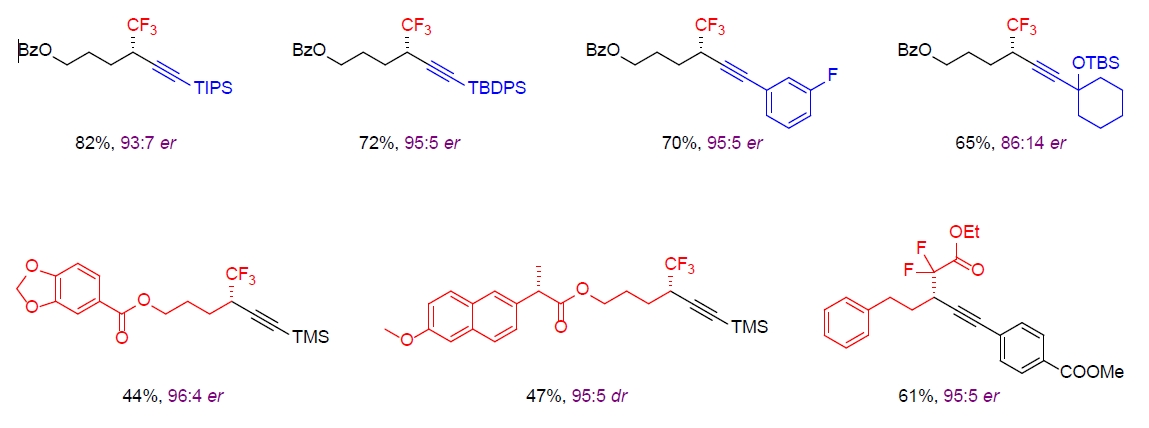
该反应有着优秀的底物普适性,对于不同的烷基亲电试剂和炔基化底物,都能以良好的收率和立体选择性得到目标产物。同时,温和的反应条件也使得反应具有优异的官能团兼容性。对于一些复杂的药物分子同样可以通过该方法进行后期修饰。对于反应的机理,研究人员进行了深入的研究,结合自由基实验以及理论计算充分证明了该反应中卤素原子转移过程的必要性,从而验证了提出的反应设想和催化循环过程。
徐涛课题组一直致力于发展具有自身鲜明特色的研究领域,目前主要聚焦于羰基去氧双官能团化(DODC)和光镍双催化不对称还原偶联。新的构建策略顺利实施进一步证明了光镍双催化不对称还原偶联体系的优势,为该课题组后续实现醇的不对称去氧偶联反应奠定基础。
徐涛教授为论文通讯作者,硕士研究生陆珊娅为第一作者。该研究工作得到了国家自然科学基金、小米青年学者基金以及中央高校基本科研业务费专项资金资助等项目的资助。
论文链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202406064