同济大学医学院徐俊团队探索骨关节炎的创新治疗技术,研究成果发表于《纳米生物技术杂志》
来源:医学院
时间:2023-10-20 浏览:
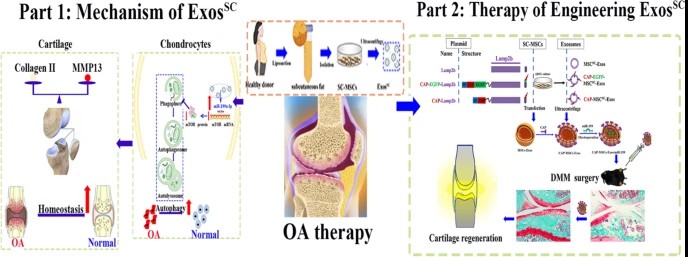
骨关节炎(Osteoarthritis,OA)作为一种最常见的慢性关节退行性疾病,主要表现为关节软骨退变、滑膜炎症、软骨下骨硬化和韧带增生等,严重影响患者的身体健康和生活质量。腹部脂肪来源的间充质干细胞(SC-MSC),作为一种更容易获得并较为丰富的MSC类型,以其强大的增强能力和免疫调节功能,已逐渐成为组织工程和再生医学的有力工具。外泌体因其优异的生物相容性、低免疫性、生物屏障穿透性和靶向递送能力,成为临床治疗的关注热点。目前的研究多集中在野生型的SC-MSC来源的外泌体,然而其治疗骨关节炎的相关分子机制尚不明确,并且还未见SC-MSC来源的外泌体作为药物递送系统在骨科疾病上的研究。
近日,同济大学医学院徐俊教授团队联合上海交通大学医学院附属第六人民医院骨科杜大江团队以及云南省第二人民医院凌斌团队在《纳米生物技术杂志》(Journal of Nanobiotechnology)发表题为“Engineering exosomes derived from subcutaneous fat MSCs specially promote cartilage repair as miR‑199a‑3p delivery vehicles in Osteoarthritis”的研究论文,首次报道了腹部脂肪来源的间充质干细胞分离的外泌体的靶向药物递送系统,探索了其递送小分子核酸药物靶向软骨细胞达到骨关节炎的创新治疗技术。

研究表明,腹部脂肪来源的间充质干细胞(SC-MSC)分离的外泌体能够有效缓解OA大鼠的关节软骨退变,转录组测序分析这种治疗作用和软骨组织的自噬过程密切相关。进一步的研究发现,SC-MSC来源的外泌体中的miR-199-3p通过抑制mTOR信号通路,促进软骨细胞的自噬水平,进而上调软骨基质合成蛋白,下调软骨基质降解蛋白,达到促进软骨细胞的代谢稳态的效果。基于腹部脂肪来源的间充质干细胞分离的外泌体本身对软骨组织的保护作用,该团队进一步研发了SC-MSC来源的外泌体(MSCSC-Exos)靶向软骨细胞的药物递送系统:CAP- MSCSC-Exos。CAP- MSCSC-Exos可以递送miR-199-3p至软骨细胞,进而达到优于野生型外泌体的更强的软骨组织治疗效果,更加改善骨关节炎的软骨组织退变。该递送系统在体外和体内的动物OA动物模型实验中均得到了很好的验证。利用CAP- MSCSC-Exos递送miR-199-3p小分子是一种有效的OA基因治疗方法。
徐俊教授为论文通讯作者,医学院博士生赵姝为第一作者。
论文链接:https://jnanobiotechnology.biomedcentral.com/articles/10.1186/s12951-023-02086-9