医学院徐大春团队联合生命科学与技术学院魏珂团队在《循环》上发表扩张型心肌病机制研究成果
来源:生命科学与技术学院
时间:2023-04-18 浏览:
扩张型心肌病(DCM)是心衰的主要发病原因之一,主要表现为心室扩大和心脏收缩功能下降。截至2015年,全球心肌病患者约250万例,10年内增长27%。目前已经确定部分心肌结构基因突变可以诱发DCM,但仍有超过50%的病例不是由基因突变导致;也有研究表明扩心病患者心肌细胞凋亡增加、能量代谢异常、慢性氧化应激等因素可能与疾病进展相关。多数DCM患者发展为终末期心衰,缺乏有效的治疗药物,2年病死率达40%,已经造成了巨大的医疗卫生负担。
4月14日,同济大学附属第十人民医院徐大春课题组、同济大学生命科学与技术学院魏珂课题组在国际心血管领域权威期刊《循环》(Circulation)在线发表了题为“Jmjd4 facilitates Pkm2 degradation in cardiomyocytes and is protective against dilated cardiomyopathy” 的研究论文。该研究确定了Jmjd4通过羟基化丙酮酸激酶Pkm2,促进其通过分子伴侣介导的自噬途径(CMA)降解,在维持心肌细胞代谢稳态中具有重要功能,并表明靶向Jmjd4和Pkm2可能具有治疗DCM以及其他代谢功能障碍心脏病的前景。

首先,研究人员分析了人类扩张型心肌病、小鼠心肌肥厚以及心梗组织中Jmjd4的表达情况,发现Jmjd4在心脏疾病中表达明显上调,表明Jmjd4很可能是心衰进展过程中的重要效应蛋白。随后研究者构建了可诱导心肌特异性Jmjd4敲除小鼠,发现Jmjd4在成年心肌细胞中被诱导敲除后,小鼠自发出现扩张型心肌病表型,表现为心室扩张,伴随严重的病理性重塑,并迅速进展为心衰,死亡率极高。研究者对Jmjd4条件性敲除小鼠的心肌组织和体外敲减Jmjd4的心肌细胞进行了全转录组测序,结果发现体内、体外敲减Jmjd4后的表达下降的基因均富集在线粒体代谢相关的通路上,而功能性研究发现Jmjd4缺失的确导致线粒体氧化呼吸水平降低。代谢组学分析发现,Jmjd4敲除心肌细胞的糖酵解过程中丙酮酸上游底物积累,而下游产物浓度降低,提示丙酮酸代谢异常。随后,研究者通过免疫共沉淀联合质谱技术鉴定了心肌细胞中与Jmjd4相互作用的蛋白,发现Jmjd4与生成丙酮酸的代谢酶丙酮酸激酶Pkm2相互作用。为了阐述Jmjd4是否通过调节Pkm2影响心肌细胞代谢,研究者首先检测了Jmjd4敲减(除)情况下Pkm2的转录本和蛋白表达量,结果发现Jmjd4敲减(除)对Pkm2的转录本水平没有影响,蛋白表达量显著升高。相应地,过表达Jmjd4使Pkm2蛋白水平显著降低。这提示Jmjd4很可能通过翻译后机制影响Pkm2的表达。随后研究者使用蛋白降解系统相关的一系列抑制剂及激动剂(MG132、CHX、QX77等),及免疫共沉淀等实验,进一步确认了Jmjd4通过分子伴侣(Hsp70)介导的自噬途径(CMA)促进Pkm2的降解。
为了进一步阐明Jmjd4促进Pkm2降解的机制,研究者通过质谱技术确定了Pkm2的Jmjd4羟基化修饰位点(K66),并通过实验证明该位点的突变体K66R不能结合降解过程的核心分子Hsp70。为解除积累的低酶活Pkm2对心肌细胞代谢的阻滞,研究者使用Pkm2变构激动剂TEPP-46成功治疗挽救了Jmjd4条件性敲除小鼠的扩心病表型。由于Pkm2在多种心脏疾病中积累,研究者在压力负荷诱导的小鼠DCM模型中使用该Pkm2激动剂,发现其同样可以部分挽救DCM表型,表明Pkm2很可能是心脏代谢干预治疗的普适性靶点。
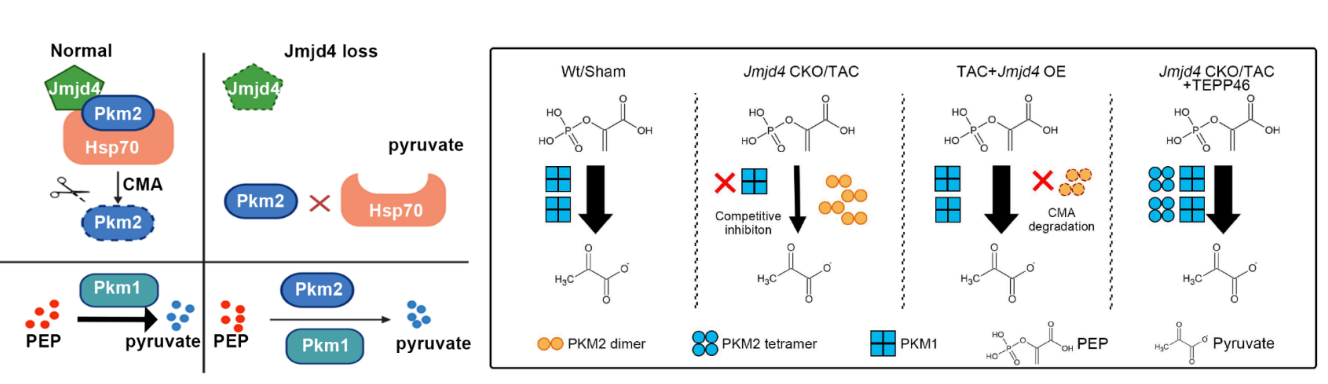
综上所述,该研究揭示了Jmjd4通过伴侣介导的自噬调节Pkm2的降解,在维持心肌细胞和心脏功能的代谢稳态中起着至关重要的作用,这为扩张型心肌病的干预提供了新的靶点。
该研究由徐大春教授和魏珂教授共同指导完成。同济大学医学院博士生唐岩松、生命科学与技术学院博士后冯梦颖为论文共同第一作者。该研究得到了科技部重点研发计划、国家自然科学基金等多项基金和教育部“细胞干性与命运编辑”前沿科学中心的支持。
论文链接:https://www.ahajournals.org/doi/abs/10.1161/CIRCULATIONAHA.123.064121#d40659391e203