同济团队联合研发的高效灭杀癌细胞的新型载酶磁性纳米凝胶问世
来源:新闻中心
时间:2019-12-27 浏览:
2019年12月13日,我校化学科学与工程学院王启刚团队、医学院及附属东方医院成昱团队联合研发的新型载酶磁性纳米凝胶问世,可用于高效灭杀癌细胞。该项成果在线发表在德国《应用化学》(Angew. Chem. Int. Ed.)上(DOI: 10.1002/anie.201915118.)。
成昱介绍,彻底治愈肿瘤是人类的梦想。但是,癌细胞与正常细胞不同,它有无限增殖、可转化和易转移三大特点,能够无限增殖并破坏正常的细胞组织。癌细胞除了分裂失控外,还会局部侵入周遭正常组织甚至经由体内循环系统或淋巴系统转移到身体其他部分。人类已经为阻滞这种趋势奋斗了近百年,科学家和医生们一起奋战,寻找根治抗肿瘤的金钥匙。
王启刚认为,肿瘤细胞依赖自身的抗氧化防御系统来维持自身的活性氧(reactive oxygen species,ROS)水平,达到氧化-还原平衡,以保持正常的生理活动。可否通过上调肿瘤区域的ROS水平,打破癌细胞脆弱的氧化还原平衡,使其功能紊乱乃至凋亡、坏死,从而实现抗肿瘤治疗?现在普遍采取的是施加射线、激光等物理因素,产生外源性ROS杀伤肿瘤细胞,代表性疗法有放疗、光动力治疗等。
可否通过来自线粒体的有氧呼吸和代谢过程,产生内源性ROS,并施加外在物理调控力,通过体内生物酶的特异催化活性来上调机体的ROS 水平,达成肿瘤治疗的目的?王启刚团队和成昱团队一拍即合,决定采取在肿瘤细胞中“点火”的方法,探索抗肿瘤的新方法。
团队利用磁性纳米材料作为磁热介质为肿瘤“点火”,通过酶的高效生物催化作用引发内源性ROS的“爆发”,研发了新型载酶磁性纳米凝胶(MNP-CPO@Nanogels),作为一种程序化可控活化的仿嗜中性粒细胞模拟物,控制上调细胞内氧化活性最强的单线态氧(1O2),即磁酶联合治疗(METT),展开肿瘤灭杀工作。据悉,该磁性纳米凝胶以锌掺杂的磁性四氧化三铁(Fe3O4)纳米颗粒为核,通过酸性磷酸酶诱导寡肽小分子界面自组装,可在磁性Fe3O4纳米颗粒表面包覆一层凝胶层;同时,借助非共价键作用,载负氯过氧化物酶 (CPO),使其具有良好的结构稳定性和催化活性。细胞水平上,这种新型载酶磁性纳米凝胶介导的磁酶联合治疗可依次调控细胞内及1O2。磁热(43 ℃)可触发细胞内生化信号过氧化氢(H2O2)的产生,继而被氯过氧化物酶催化生成毒性更强的1O2,迫使80%的肿瘤细胞凋亡。
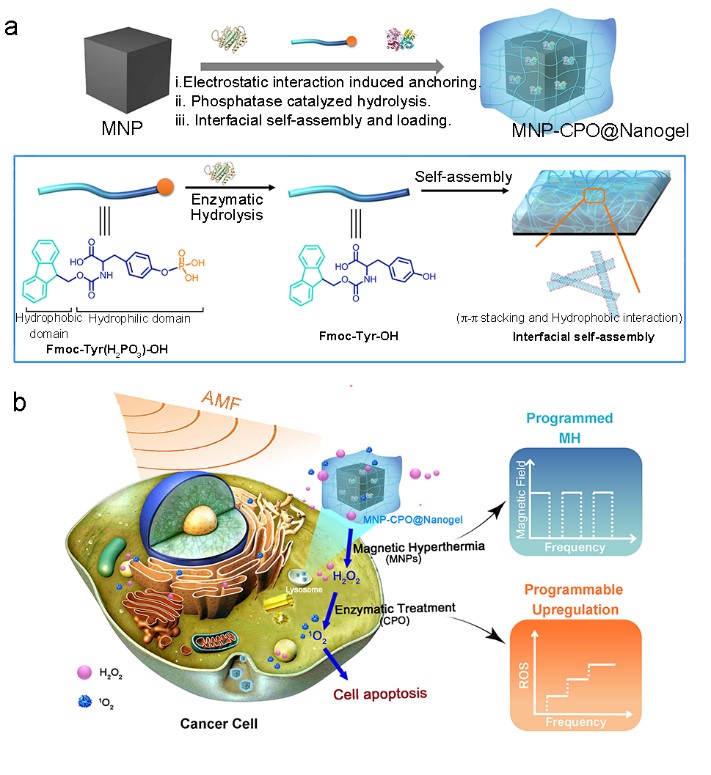
磁-酶联合治疗 (METT)示意图
试验表明,在原位脑胶质瘤模型中,磁酶联合治疗可使肿瘤小鼠的生存期延长30%。此外,在乳腺癌皮下瘤尾静脉给药试验组,新型载酶磁性纳米凝胶经磁引导后在肿瘤部位可大量富集,外加磁场介入后显示出明显抑制肿瘤生长的效果;其瘤内给药模型中,磁酶联合治疗治疗组的小鼠肿瘤完全消失,肿瘤被根除。动物实验中,磁酶联合治疗均对正常组织无明显损伤。
成昱介绍,此项研究结果表明,磁酶联合治疗可通过外加磁场的调控,实现对热及生化信号的时空调控,兼顾组织穿透深度,有效且安全,为深层肿瘤根除提供了物理与生化协同治疗的新方法。
论文的共同第一作者是王启刚团队博士研究生张琦,成昱团队博士研究生吴交交和科研助理王静静。共同通讯作者是同济大学化学科学与工程学院的王启刚教授和医学院及附属东方医院的成昱教授。项目受到国家重点研发计划、张江国家自主创新示范区专项发展基金重大项目、国家自然科学基金、上海市教委科研创新计划重大创新项目、上海市科委、中央高校经费等大力支持。
据了解双方团队将继续深化磁酶联合治疗机制研究,积极推进该治疗体系的临床转化,为人类抗肿瘤事业提供更加高效、安全的“火种”。(程国政)