生命科学与技术学院李维达教授与高绍荣院士合作开发“耐逆型”胰岛类器官(SC-islet),成果发表于《细胞研究》
突破糖尿病干细胞治疗长期存活瓶颈
来源:生命科学与技术学院
时间:2026-01-29 浏览:
糖尿病细胞治疗长期受限于一个悬而未决的根本难题——移植后的胰岛β细胞难以在糖尿病病理微环境中实现长期存活并维持稳定功能。临床随访数据表明,多数胰岛移植在约5年后出现显著的β细胞功能衰退与治疗效果减弱。干细胞来源的β细胞(SC-β细胞)也面临相同的困境。这一移植后的“长期存活瓶颈”,已成为制约糖尿病细胞治疗进一步走向临床应用与规模化推广的关键因素。如何突破该瓶颈,实现具备长期稳定疗效、甚至“一次性”治愈潜力的治疗方案,正是当前糖尿病细胞治疗领域亟需解决的核心目标。
1月28日,同济大学生命科学与技术学院李维达教授团队与高绍荣院士合作在《细胞研究》(Cell Research)上在线发表题为“Zinc accumulation-induced integrated stress response triggers β-cell identity loss”的研究论文,揭示了在糖尿病发生发展过程中,锌离子异常积累是导致β细胞身份丢失的核心驱动因素,并证实介导锌离子积累的转运蛋白ZnT8是糖尿病预防与治疗的重要靶点。该研究发现,β细胞内过载的锌持续激活整合应激反应(Integrated Stress Response, ISR),并通过ISR下游转录因子ATF4启动α细胞特异性转录因子ARX异位表达,从而在分子层面推动β细胞转分化。这一发现为糖尿病细胞治疗长期疗效不足提供了全新解释与潜在干预靶点。

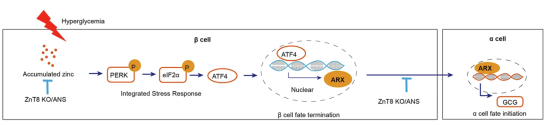
基于这一机制突破,研究团队创新性地提出并验证了“耐逆型胰岛类器官”这一全新技术路径。与传统细胞治疗主要关注细胞产量或短期功能改善不同,该路径将胰岛类器官在代谢压力下的功能稳定性与生存耐受性作为核心指标,在类器官制备阶段就赋予其“耐逆”特性——如同为细胞穿上“防弹衣”,从源头上解决糖尿病细胞治疗长期疗效不稳定这一临床转化痛点。在具体实施层面,团队围绕“锌离子过度积累”这一关键可干预节点,通过靶向胰岛特异性锌转运蛋白ZnT8,有效抑制病理状态下β细胞内异常锌离子积累,提升SC-β细胞在糖尿病高血糖下的身份保护,防止β细胞“叛变”,实现“耐逆”效果,使得移植后的SC-β细胞能够在糖尿病微环境中保持更持久的功能输出,显著降低了细胞治疗过程中最难以控制的长期失效风险。
本项工作所阐明的是糖尿病细胞治疗范式的一次结构性调整。在这一框架下,β细胞不再是被动消耗的功能单元,而是需要被长期维护其命运稳定性的核心主体。当下,糖尿病细胞治疗正处于从“概念验证”迈向“长期可持续疗效”的关键阶段,“耐逆型胰岛类器官”代表的是一条更具临床转化确定性、迭代性的技术路径,旨在解决细胞治疗能否真正成为糖尿病“一次性”治疗方案的根本问题。
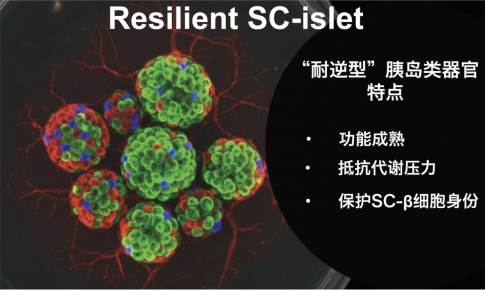
李维达教授长期致力于糖尿病干细胞治疗的临床转化推进,为相关技术从基础研究走向转化应用提供了重要保障。在此突破性进展基础上,团队正加速推进“耐逆型胰岛”相关技术的临床转化工作,将这一有望重新定义糖尿病治疗模式的科研成果,转化为真正惠及全球数亿患者的突破性治疗方案。本项研究亦得到了瑞吉维思公司的大力支持。
同济大学博士后研究人员马青、博士后研究人员许文君、博士研究生王轩、硕士研究生聂浩宇为该论文的共同第一作者,同济大学李维达教授、高绍荣院士为该论文的共同通讯作者。
原文链接:https://www.nature.com/articles/s41422-026-01222-y