生命科学与技术学院丁德强团队揭示piRNA加工复合物动态组装的分子机制,成果发表于《欧洲分子生物学学会杂志》
来源:生命科学与技术学院
时间:2025-10-09 浏览:
PIWI-interacting RNA(piRNA)是一种在生殖细胞中高表达的长度为19-32nt的小非编码RNA。piRNA与PIWI蛋白家族成员结合形成PIWI-piRNA复合物,通过抑制转座子活性维持生殖细胞基因组稳定性,同时在多个层面发挥基因表达调控的功能,是哺乳动物生殖细胞发育所必需的。piRNA的生成是一个极其复杂的生物学过程,需要多种蛋白参与其中,包括核酸外切酶、核酸内切酶、RNA解螺旋酶、RNA甲基转移酶、分子伴侣、接头蛋白等,这些蛋白聚集在生殖细胞的线粒体外膜表面形成piRNA加工复合物。PIWI-piRNA复合物加工成熟后会离开线粒体膜表面,在细胞质或者细胞核中发挥下游功能。但是,piRNA加工复合物在线粒体膜表面的动态组装机制还很不清楚。
9月29日,同济大学生命科学与技术学院/附属妇产科医院丁德强教授团队在《欧洲分子生物学学会杂志》(The EMBO Journal)上在线发表题为“PIWI proteins tether the piRNA biogenesis machinery to mitochondria during mammalian spermatogenesis”的文章。该研究工作揭示了PIWI蛋白在piRNA加工复合物在线粒体膜上的动态组装过程中发挥的关键作用。

目前已知有四种线粒体膜蛋白在piRNA加工过程中发挥重要功能(TDRKH、ASZ1、mitoPLD、GPAT2),其他piRNA相关蛋白被未知的机制募集到线粒体膜表面。研究团队系统性地研究了piRNA加工复合物中的线粒体膜蛋白对非线粒体膜蛋白的募集作用。实验结果发现ASZ1特异性募集PIWIL2,TDRKH特异性募集PIWIL1和PIWIL4,这两个线粒体蛋白对除了PIWI蛋白之外的其他十几种已知piRNA相关蛋白均没有显示出明显的募集作用。另外两种线粒体蛋白mitoPLD和GPAT2没有对任何piRNA相关蛋白显示出明显的募集作用。这一结果表明线粒体蛋白对PIWI蛋白的募集作用具有很强的特异性。
研究团队首先聚焦ASZ1对PIWIL2的募集作用。实验结果显示ASZ1的N端与PIWIL2蛋白中部形成的沟槽部位结合。有趣的是,PIWIL2的这一位置正是piRNA3'末端结合的位置。PIWIL2结合piRNA后破坏了PIWIL2与ASZ1的相互作用,PIWIL2-piRNA复合物得以从piRNA加工复合物中解离出来发挥下游功能。由于线粒体膜蛋白特异性地募集PIWI蛋白,研究人员推测其他piRNA相关蛋白是通过PIWI蛋白间接地锚定在线粒体膜上。实验室前期工作证明TDRD1通过相分离活性促进piRNA加工复合物的组装,但其线粒体定位机制还很不清楚。进一步的研究发现PIWIL2通过不同的位点同时与TDRD1和ASZ1相互作用,形成ASZ1-PIWIL2-TDRD1复合物,作为核心组分启动piRNA加工复合物的组装。之前的研究工作已经证明了TDRKH对PIWIL1的募集作用,此项工作中进一步研究发现PIWIL1作为另一个重要的PIWI蛋白,同时与TDRKH和TDRD1相互作用,形成TDRKH-PIWIL1-TDRD1复合物,与ASZ1-PIWIL2-TDRD1复合物共同促进piRNA加工复合物的组装。
综上所述,该研究揭示了在哺乳动物精子发生过程中piRNA加工复合物在线粒体膜上的动态组装过程:在胚胎期以及新生小鼠的性原细胞(gonocyte)中,ASZ1-PIWIL2-TDRD1作为核心组分,启动piRNA加工复合物的组装;在减数分裂期的粗线期精母细胞中,ASZ1-PIWIL2-TDRD1和TDRKH-PIWIL1-TDRD1两个复合物共同促进piRNA加工复合物的组装。PIWI蛋白与piRNA结合破坏了PIWI蛋白与线粒体膜蛋白的相互作用,促使PIWI-piRNA复合物离开线粒体膜,进一步被运输到发挥功能的区域。该工作对于理解piRNA生成的分子机制具有重要意义。
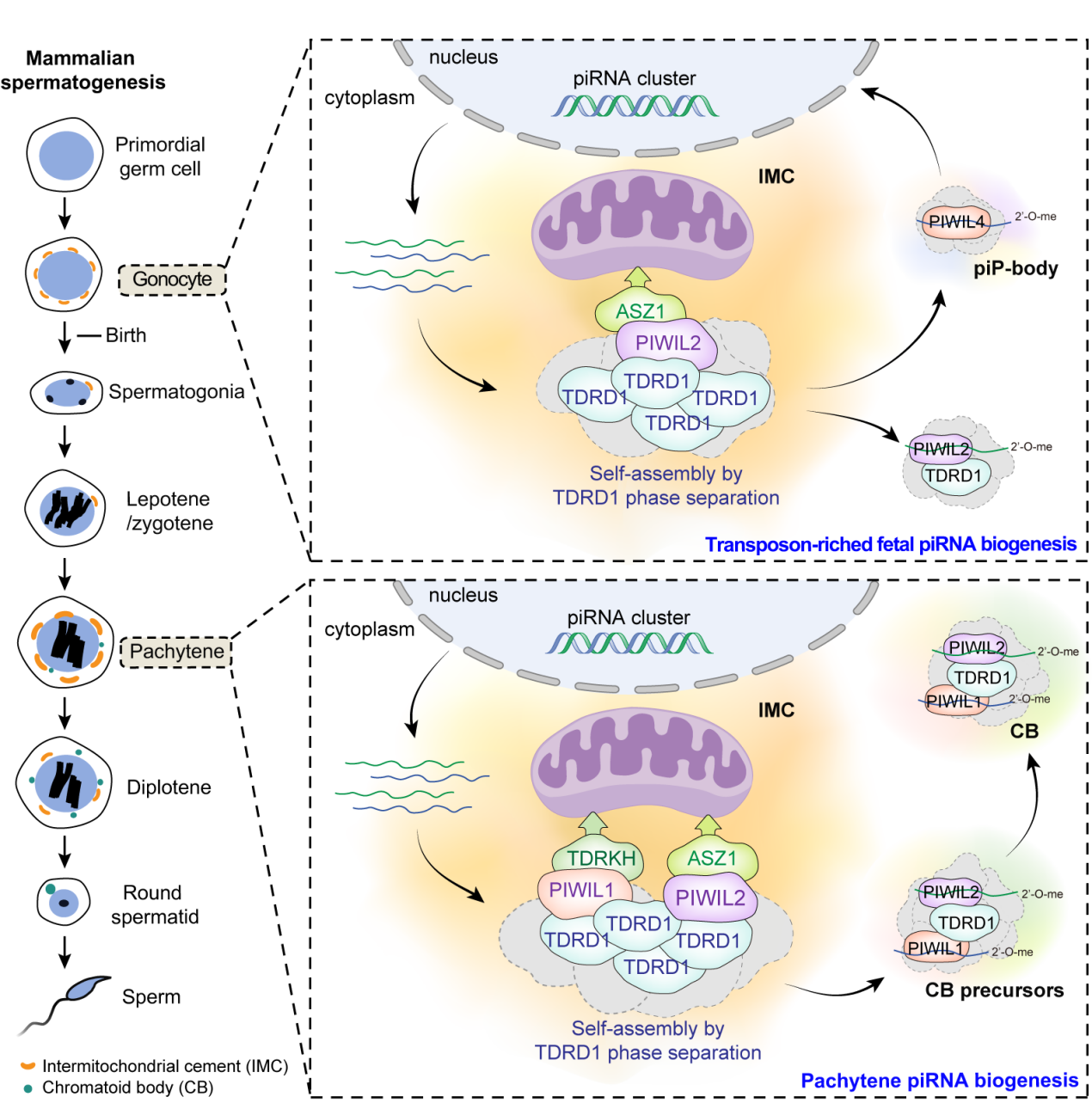
piRNA加工复合物动态组装的分子机制
生命科学与技术学院博士后高洁和博士生陈璨梅为论文共同第一作者,丁德强教授为论文通讯作者。研究工作还得到了同济大学生命科学与技术学院/附属妇产科医院张云芳教授以及美国密歇根州立大学Chen Chen教授的大力支持和帮助。该项研究得到了国家重点研发计划以及国家自然科学基金委员会面上项目的资助。
论文链接:https://doi.org/10.1038/s44318-025-00579-x