【编者按】在上海市科学技术委员会资助(项目编号:22DZ2304300)下,澎湃新闻联合《世界科学》对获得国家及上海市科技奖励的获奖成果进行科普化报道。
本篇报道围绕2022年度上海市科学技术奖自然科学一等奖项目“脊髓损伤分子病理与修复机制”展开。该项目由同济大学附属同济医院教授、主任医师程黎明主持完成。

同济大学附属同济医院骨科脊柱神经康复团队
骨头骨折可以通过打石膏等方式修复,但若是骨髓中的神经组织损伤了呢?
尤其是,负责“上传下达”的信号“大动脉”——脊髓受伤了呢?只能瘫痪?
国家重点研发计划首席科学家、同济大学医学与生命学部副主任、同济大学脊柱脊髓损伤教育部重点实验室主任、教授程黎明一直聚焦这一难题的攻关。
在接受澎湃科技专访时,他说:“(脊髓损伤)就像路边的电线杆倒了,把电线杆扶起来很容易,但要把断了的电线接上,却要花一番功夫。”他带领团队,创立了脊柱脊髓损伤全过程康复新策略及再生康复新体系。
程黎明主持完成的“脊髓损伤分子病理与修复机制”项目此前获得2022年度上海市科学技术奖自然科学奖一等奖。
他带领的研究团队发现,小胶质细胞极有可能成为脊髓损伤修复的新靶点。他们通过医工交叉,改良了促进修复的材料,并开展了国家卫健委批准的唯一一项人源性神经干细胞移植治疗脊髓损伤的临床研究。
病理如“黑箱”,如何找到脊髓损伤修复的关键靶点?
脊髓损伤(Spinal Cord Injury,SCI)的再生修复一直是再生医学领域的热点和难点,目前临床上仍缺乏有效的治疗及康复方法。SCI具有发病率高、治疗费用高、致残率高、发病年龄低等特点。《中国脊髓损伤者生活质量及疾病负担调研报告2023版》显示,根据既往研究数据,中国现存脊髓损伤患者374万人,每年新增脊髓损伤患者约9万人。
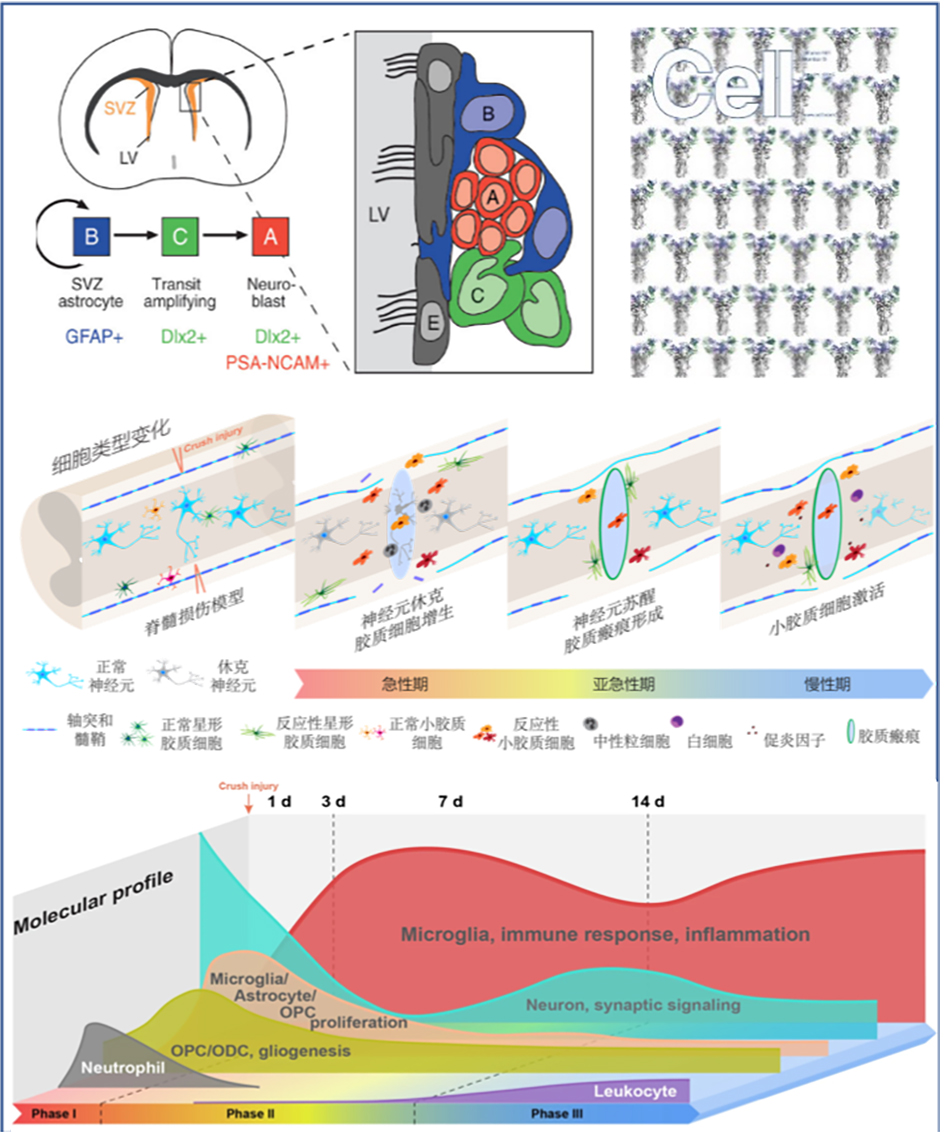
在Cell和STTT杂志上发表研究论文揭示脊髓损伤分子病理机制
脊髓损伤后神经功能的恢复取决于神经环路的完整性和可塑性,神经元轴突的断裂和神经元的死亡会导致神经回路功能紊乱,因此,神经环路的可塑性是神经功能恢复的基础。
然而,脊髓损伤后内源性神经干细胞和免疫细胞被大量激活,病理进程异常复杂,这使得神经环路的重塑异常困难,程黎明说,“包括脊髓在内的中枢神经系统(CNS)损伤通常会导致感觉、运动和自主神经功能的永久性损害,目前为止仍没有有效的治疗方法,SCI的病理机制犹如一个‘黑箱’,至今仍不完全清楚。”此外,不同类型细胞在SCI中的作用,如免疫细胞、星形胶质细胞、小胶质细胞等,也存在争议。
程黎明表示,既往大量研究表明其治疗难点在于如何改善损伤区的微环境,从而实现神经再生和功能重塑。“且目前关于脊髓损伤后损伤微环境的知识也相当有限,详细了解这些过程可能有助于开发针对不同病理过程的最优治疗方法。”
依托“脊柱脊髓损伤再生修复”教育部重点实验室,在国家重点研发计划、国家自然科学基金国际(地区)合作项目的支持下,程黎明开始了他的研究。
近年研究发现,中间神经元可能为近端和远端神经元提供桥梁并形成新的神经环路,已成为脊髓损伤修复的研究重点。而这些关键的中间神经元可能来自脊髓原始中间神经元、移植的干细胞,或内源性神经干细胞分化出来的神经元、星形胶质细胞和少突胶质细胞。
程黎明带领的研究团队对雄性和雌性成年小鼠,在损伤后不同时间点未受伤和受伤的脊髓组织进行了群体测序(39个组织样本)和单细胞测序(59558个细胞)综合分析。数据揭示了发生在神经元、小胶质细胞、星形胶质细胞、内皮细胞等脊髓组织主要细胞类型的大多数分子病理动态变化。
研究数据表明:小胶质细胞和星形胶质细胞在未受伤的脊髓中似乎已有多种亚型,这些亚型在损伤后迅速发生表型转变。而小胶质细胞的激活有两个阶段:第一阶段在损伤早期激活,7天后有所恢复;第二阶段在损伤后 14 天再次激活,这与神经元的继发性损伤相吻合。有趣的是,虽然其他很多细胞类型的变化往往会最终恢复到未受伤状态,但小胶质细胞似乎会永久地切换到不同的转录状态,从而导致脊髓免疫微环境发生更长期的变化。
同时,研究团队发现,在成年小鼠脊髓损伤后,也检测到具有促进新生小鼠再生的,小胶质细胞特征的小胶质细胞亚类,但与新生小鼠相比,其基因表达存在细微差异。改变这些细微差异或许有助于脊髓修复。
“这也就意味着,也许小胶质细胞极有可能成为脊髓损伤修复的新靶点。”程黎明说道。

程黎明教授
寻找点亮“生命之树”的方法
问题的另一个关键是如何点亮这些关键细胞,以促进神经元的再生和恢复。
找到合适的点亮细胞的材料很重要。程黎明解释:“就像电影《阿凡达》里的‘生命之树’,死去的生物与其相连,能获得新生,我们就在找这样的材料。”
在“医工交叉”的大背景下,程黎明找到了同济大学纳米生物医药专家,合作研发了一种可生物降解,能调节损伤区免疫细胞分型,抑制炎症反应的层状双氢氧化物(LDH)纳米材料——LDH-NT3。
具体来说,该材料具有神经免疫双调控功能,可显著促进神经干细胞(NSCs)的迁移、神经分化,激活L-Ca2+通道并诱导产生动作电位。研究团队提出一种脊髓修复策略:利用该材料激活特定靶点TGFBR2,并协同调控神经干细胞及小胶质细胞。
研究人员将LDH负载神经营养因子NT3后,形成纳米复合体系LDH-NT3,并将其移植于小鼠的脊髓损伤区域,在损伤区可见新生的内源性神经干细胞和功能神经元,脊髓损伤小鼠的行为学和电生理评价显著提高。程黎明表示,“LDH材料本来就具有促进神经再生的作用,而我们又将其改良,形成了更优良的LDH-NT3材料,结果显示,新材料对小鼠的脊髓损伤修复效果比LDH更好。”
“我们还在做一系列准备工作。我不知道哪天能让这项成果走向临床,也许很快,也许要奋斗一生。但做科研就是这样。”程黎明说道。

程黎明教授指导脊髓损伤患者进行康复训练
2022年10月,程黎明与两位脊髓移植患者进行了面对面谈话。他们参与了程黎明主导、国家卫生健康委员会批准的干细胞临床试验项目——人源性神经干细胞移植治疗脊髓损伤安全性与初步有效性评价临床研究,该项目是截至成稿时国家卫健委批准的唯一一项人源性神经干细胞移植治疗脊髓损伤的临床研究。两位受试者在经过康复治疗,以及干细胞治疗后,脊髓恢复情况得到好转。
“知识的海洋无穷无尽。我和我的团队能发现脊髓治疗的一点奥秘已经很幸运了。作为一名临床医生,满足还未满足的临床需求是我最大的心愿,所以未来我的工作重点将继续聚焦相关基础研究,并加快实现已有成果的临床转化。”程黎明说道。
链接:https://m.thepaper.cn/newsDetail_forward_29108601