隐球菌病(Cryptococcosis)是指主要经呼吸道吸入环境中的新型隐球菌(Cryptococcus neoformans, C. neoformans)及其变种引起的一种急性、亚急性或慢性肺部真菌病,可经中枢系统传播至脑部,在免疫低下患者中严重危及生命。临床和实验数据表明CD4+T 细胞介导的免疫 (CD4+T-cell-mediated immunity,CMI) 对控制隐球菌感染至关重要,然而,隐球菌感染的一个重要标志是以较差的CMI及促炎反应为特征的系统性免疫抑制。因此,迫切需要开发新的免疫治疗策略以增强CD4+T 细胞反应抵抗隐球菌感染。
7月14日,同济大学附属第十人民医院贾鑫明教授、上海交通大学医学院附属瑞金医院瞿介明教授课题组合作在Nature Communications上发表了题为“Inhibition of myeloid-derived suppressor cell arginase-1 production enhances T-cell-based immunotherapy against Cryptococcus neoformans infection”的研究。该研究揭示了新型隐球菌主要荚膜多糖成分葡聚糖醛木糖甘露聚糖(glucuronoxylomannan, GXM)通过诱导机体粒细胞样髓系来源免疫抑制性细胞(PMN-MDSCs)的聚积及功能抑制机体对隐球菌的清除,加重感染,并通过进一步鉴定GXM的识别受体及下游通路为抗隐球菌感染提供了新的潜在免疫治疗靶点与策略。

MDSCs(Myeloid-derived suppressor cells)是2007年才定义的一群来源于髓系始祖细胞和未成熟髓系细胞的异质性细胞群,具有显著的免疫抑制作用,根据核型特征及表面标志分为单核样M-MDSCs及粒细胞样PMN-MDSCs两个亚型。研究人员首先发现在隐球菌肺部感染小鼠模型、临床隐球菌肺炎及隐球菌脑膜炎患者中PMN-MDSCs均显著增加。为进一步明确PMN-MDSCs在隐球菌感染中的功能,研究者分别使用anti-Ly6G及anti-DR5抗体成功清除小鼠体内PMN-MDSCs,结果发现可显著增加小鼠隐球菌感染后的生存率及降低肺部荷菌量(图1)。以上结果说明新型隐球菌感染可诱导MDSCs,尤其是PMN-MDSCs的招募并加剧感染过程,中和该类免疫抑制性细胞可对抗隐球菌感染。
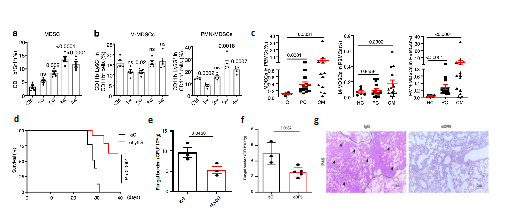
图1 PMN-MDSCs在隐球菌感染中募集
(图源:Li, et al., Nat Commun, 2022)
进一步的研究表明,隐球菌主要荚膜多糖成分GXM是诱导PMN-MDSCs聚积的关键成分,并可以通过增加MDSCs精氨酸酶-1(Arg-1)的表达来抑制T细胞增殖及功能(图2a-c)。为明确GXM的识别受体及下游信号通路,分析发现GXM处理MDSCs后C型凝集素受体Clec2d表达显著上调,并通过构建Clec2d受体胞外段与人Fc段融合蛋白(hCLEC2D-hFc)与隐球菌共培养、多糖竞争性结合、Clec2d胞外段截断体结合、氨基酸位点突变等实验多方面证实Clec2d可特异性识别GXM(图2d-h)。这些数据证实了GXM诱导PMN-MDSCs中Arg-1的表达是引起免疫抑制效应的重要分子,并进一步寻找到特异性识别GXM的关键性受体Clec2d。
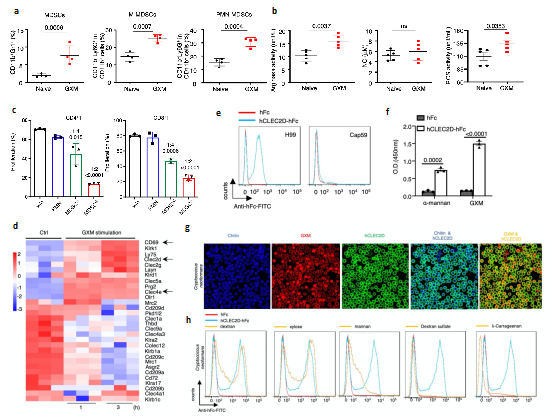
图2 GXM引起PMN-MDSCs聚积并被CLEC2D特异性识别
(图源:Li, et al., Nat Commun, 2022)
为进一步明确GXM引起隐球菌感染免疫抑制的内在机制,研究者构建了Clec2d基因敲除小鼠(Clec2d-/-),同时对比野生型WT小鼠骨髓来源MDSCs的转录组,KEGG通路富集与GSEA分析均表明MAPK通路变化显著,Clec2d-/-小鼠中p38通路激活被抑制,且使用p38抑制剂可显著降低MDSCs表达Arg-1(图3a-e)。同时,利用p38小分子抑制剂SB202190治疗小鼠肺部隐球菌感染,可显著提高小鼠生存率并降低肺部荷菌量;更有意义的是,研究者筛选了597种非专利口服药物,发现凡德他尼可体外抑制GXM诱导的p38通路激活,体内实验证明该药物同样可以显著提高隐球菌感染后小鼠存活率,促进隐球菌的清除,显著提高Th1及Th17细胞比例与功能(图3f-i)。以上结果表明GXM通过CLEC2D-p38-ARG-1信号轴激活MDSCs免疫抑制功能,同时为干预p38通路抑制ARG-1的表达从而抗新型隐球菌感染免疫治疗策略提供了理论依据。
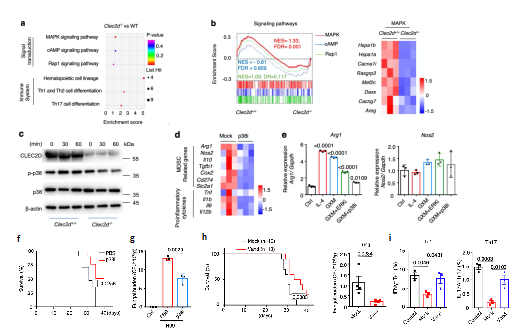
图3 抑制p38通路及ARG-1表达抵抗隐球菌感染
(图源:Li, et al., Nat Commun, 2022)
隐球菌感染的控制与清除主要依赖于T细胞免疫反应,先前研究表明隐球菌作为一种免疫惰性真菌,感染后引起的促炎反应较弱且会出现机体免疫抑制,导致隐球菌的治疗尤其在免疫缺陷人群中效果不佳。该研究从临床病例及动物模型出发,揭示了GXM诱导的PMN-MDSCs的募集与免疫抑制功能活化是造成隐球菌感染难治性的关键因素,同时进一步明确了MDSCs识别GXM的特异性C型凝集素受体CLEC2D及下游p38-ARG-1信号轴,通过小分子抑制剂及药物筛选发现,抑制该通路可显著减轻隐球菌感染并提高小鼠生存率,因此为抗隐球菌感染提供了新的潜在免疫治疗靶点与策略。综上,未来该方向的进一步探究或许可以为基于MDSCs的免疫疗法提供更广阔的应用空间及思路。
瑞金医院助理研究员李亚男博士、同济大学附属第十人民医院助理研究员王中伟博士、同济大学博士研究生李帆、华山医院博士研究生周泠宏为该论文的共同第一作者。该研究得到了国家重点研发计划,国家自然科学基金以及上海市科委基金的资助支持。
论文链接:https://www.nature.com/articles/s41467-022-31723-4