同济大学成昱团队合作研究微磁力动态可逆调控溶酶体,开辟胞内机械免疫治疗新路径,成果发表于《细胞研究》
来源:医学院
时间:2026-02-09 浏览:
机械力作为生命体系中普遍存在且高度保守的物理信号,是细胞感知环境变化、整合多维刺激并调控功能状态的重要基础。在免疫系统中,机械力不仅参与免疫细胞的迁移、吞噬和效应功能调节,也深度影响抗肿瘤免疫反应的启动与维持。然而,现有研究主要聚焦于细胞膜力感受器介导的机械信号转导过程,在复杂的肿瘤微环境中,如何在体内精准启动并动态调控力学信号,以有效增强抗肿瘤免疫反应,仍是该领域的重要科学挑战。
2月3日,同济大学医学院成昱团队联合附属上海市肺科医院陈昶、刘海鹏团队,机械工程与机器人学院唐一超团队,以及中国科学院上海生物化学与细胞生物学研究所杨巍维团队,在国际权威期刊《细胞研究》(Cell Research)上发表题为“Dynamic magneto-mechanical force in lysosomes induces durable macrophage repolarization for antitumor immunity”的研究论文,创新性提出了一种基于微磁力动态调控溶酶体功能的胞内机械免疫调控新策略。

在该研究中,研究团队构建了微磁力驱动溶酶体膜可逆通透性调控策略(MagLMP)。该策略利用旋转磁场驱动具有溶酶体靶向特性的氧化铁纳米马达,通过精确调控磁力矩大小,实现了对在体巨噬细胞功能状态的动态调节,并界定了溶酶体膜通透性在约1 Pa力学作用下发生可逆变化的关键阈值。进一步的机制研究表明,MagLMP可动态诱导溶酶体膜的可逆性损伤,促进半乳糖凝集素9(Gal9)在损伤位点的募集与循环激活,从而激活AMPK信号通路,并协同启动代谢重塑与NF-κB信号通路,最终实现巨噬细胞M1表型的持续极化。
在多种肿瘤模型中,该策略均显示出稳定的免疫激活与抗肿瘤效果。在皮下肿瘤模型中,无论采用肿瘤局部注射还是静脉给予纳米马达的方式,MagLMP治疗均可有效诱导肿瘤组织内巨噬细胞的显著激活与功能重塑,并抑制肿瘤生长,验证了该策略在不同给药路径下的适用性和稳健性。更为重要的是,在更贴近临床疾病特征的原位肺腺癌小鼠模型中,周期性实施MagLMP治疗不仅显著延长了小鼠的整体生存期,其中约三分之一的小鼠实现了超过300天的长期生存,凸显了该胞内机械免疫调控策略在体内复杂组织环境中的治疗潜力。
该研究首次在体内实现了对免疫细胞胞内细胞器尺度的机械力精准调控,将机械免疫调节从传统的胞外被动感知模式拓展至胞内主动力学干预层面,为在体动态调控先天免疫反应提供了新的理论基础和技术路径。
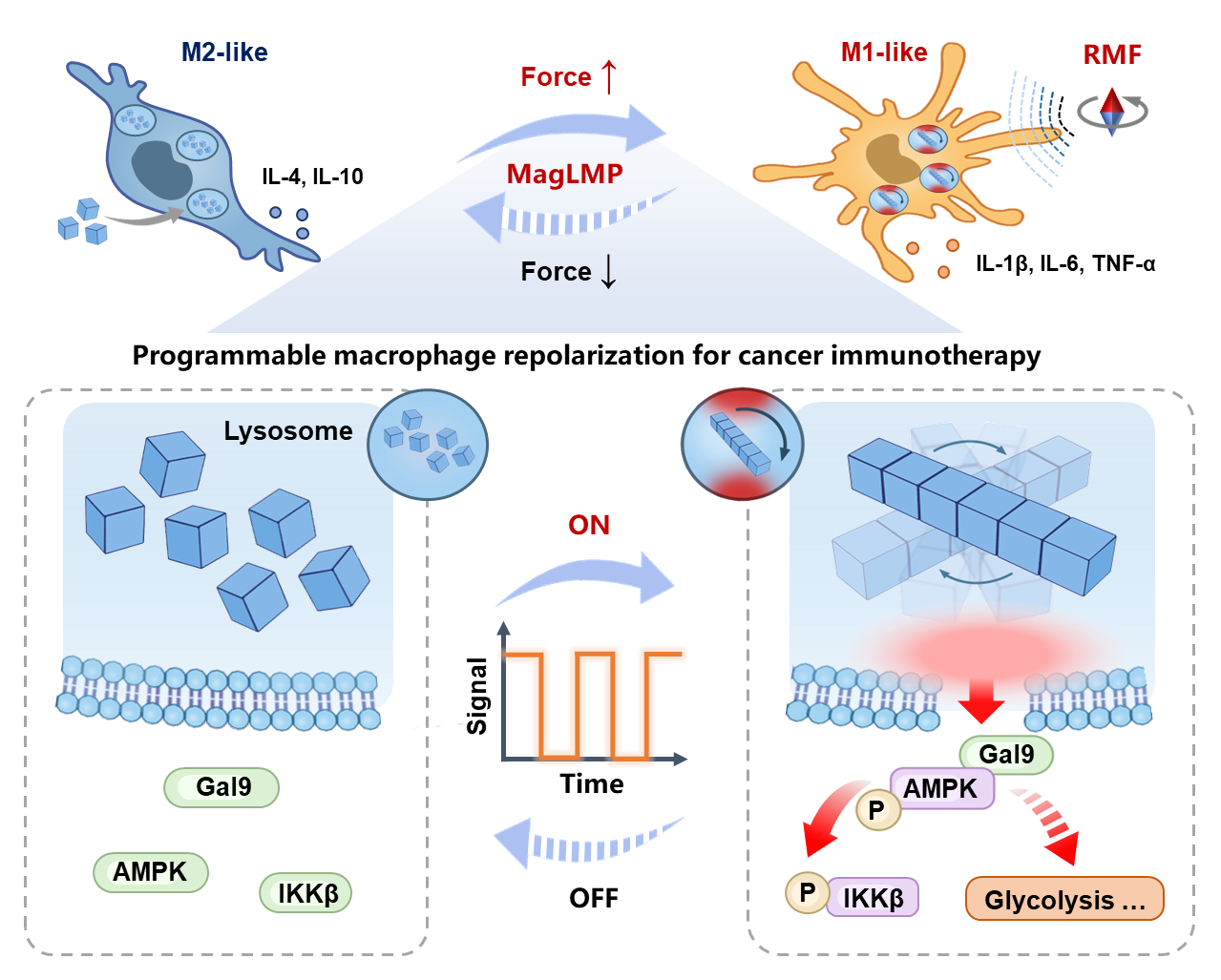
MagLMP动态诱导巨噬细胞免疫激活抗肿瘤示意图
成昱教授、陈昶教授、刘海鹏教授、唐一超教授以及杨巍维研究员为论文通讯作者,同济大学附属上海市肺科医院胸外科李瑛泽博士、中心实验室郑梦歌博士,同济大学机械与能源工程学院朱禛彦博士,以及上海交通大学医学院附属胸科医院胸部肿瘤研究所张亚娟副研究员为共同第一作者。
论文链接:https://www.nature.com/articles/s41422-025-01217-1