生命科学与技术学院边杉/毛翛/贺光等课题组揭示SNW1杂合突变导致伴原发性小头畸形神经发育障碍及其机制研究,成果发表于《临床研究杂志》
来源:生命科学与技术学院
时间:2025-09-12 浏览:
原发性小头畸形(Primary Microcephaly)是一种由基因突变引起的、先天性的严重神经发育障碍,以头围和大脑体积显著缩小为核心特征,通常导致智力障碍和发育迟缓。目前没有治愈方法,治疗主要是支持性和对症性的,及早诊断和进行积极的康复训练是改善患儿生活质量的关键。所以深入探究其病因及发病机制,对完善该疾病诊断防治体系具有关键的意义。
近日,湖南省妇幼保健院毛翛研究员、同济大学生命科学与技术学院边杉教授与上海交通大学Bio-X研究院贺光研究员共同在《临床研究杂志》(Journal of Clinical Investigation)在线发表题为“Mutations in Spliceosomal Gene SNW1 Cause Neurodevelopment Disorders with Microcephaly”的研究论文。该研究发现剪接体蛋白SNW1的杂合突变是导致伴原发性小头畸形神经发育障碍的新型遗传基因,并结合多研究模型系统揭示了其潜在的致病机制。

该研究通过跨数据库检索及多中心队列验证,首次确定了9名携带SNW1杂合变异的个体,其核心临床特征包括严重智力障碍、小头畸形、癫痫、特征性面部畸形及脑结构异常。功能实验进一步揭示,这些突变(如c.330+2 T>C和p.F412Lfs17)通过引起外显子跳跃、产生截短蛋白、破坏核定位信号以及影响蛋白稳定性,最终损害了SNW1作为剪接体核心组分的正常功能,进而影响剪接体的动态组装与催化活性。这项发现阐释了SNW1变异的致病分子机制,还为剪接因子缺陷导致神经发育障碍提供了分子层面的解释。
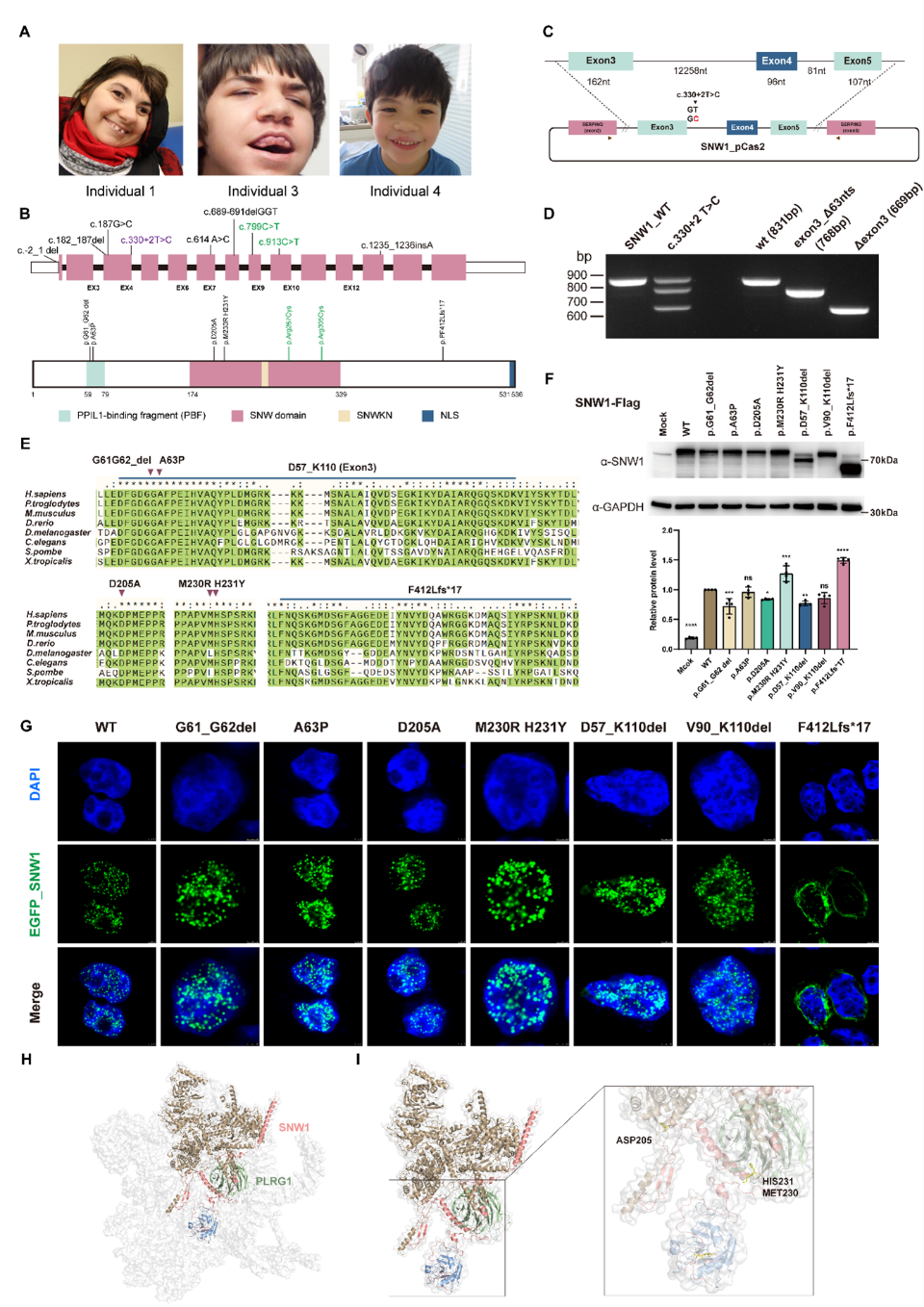
图1.SNW1基因突变会导致小头畸形,并损害SNW1在人体内的正常功能
为验证SNW1缺陷的神经发育毒性,该研究利用果蝇和人类大脑类器官模型,在体内揭示了SNW1缺失导致小头畸形的关键机制。在果蝇中,神经干细胞特异性敲低SNW1同源基因Bx42导致脑叶体积显著减小、神经干细胞数量减少以及增殖完全停滞。在人类大脑类器官中,CRISPR-Cas9介导的SNW1杂合敲除同样引起类器官体积缩小,其原因为神经干细胞增殖显著减少(pH3+、Ki67+细胞比例下降)和凋亡增加(Caspase3+细胞比例上升),但不影响神经元分化。这些从无脊椎动物到人类模型的高度一致表型,结合SNW1在人类胚胎及小鼠胎儿脑中的时空特异性表达,提示SNW1在神经发生早期阶段通过双重机制维持神经干细胞的增殖与存活和大脑正常发育,其单倍剂量不足是导致小头畸形等神经发育障碍的核心病因。
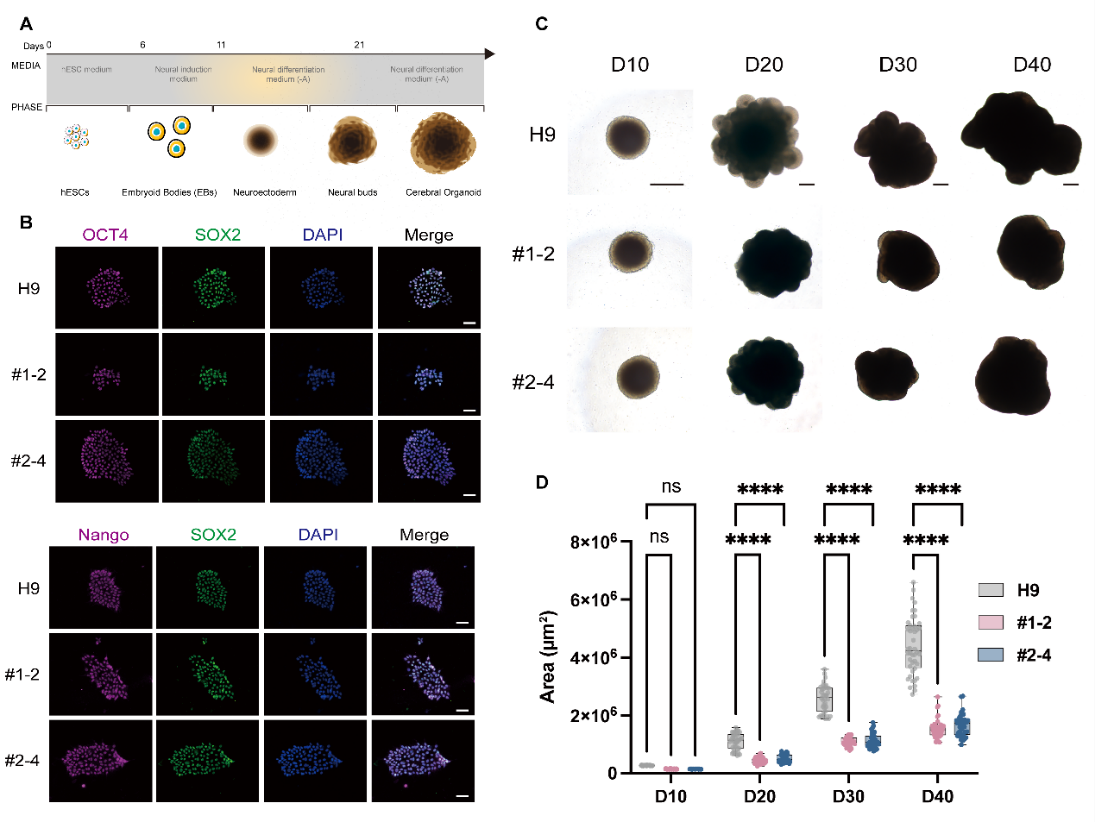
图2.果蝇和大脑类器官模型验证SNW1缺陷的神经发育毒性
通过对SNW1+/-人脑类器官的转录组分析,研究揭示SNW1缺失导致广泛的选择性剪接(AS)紊乱和基因表达失调。RNA-seq分析检测到3572个差异表达基因(DEGs),显著富集于轴突发生、前脑发育、细胞凋亡与增殖等过程;同时发现4896个异常剪接事件,其中外显子跳跃(SE)占主导(~70%),且多发生在较长外显子和高异构体数量的基因中(ESGs),显示大脑对SNW1功能缺失具有高度敏感性。进一步验证发现,多个已知神经发育疾病相关基因(如NRXN2、CENPE、MEF2C)均发生外显子跳跃及表达水平改变,且SNW1缺失倾向于避开长转录本的选择。这些结果说明SNW1作为剪接体核心组分,对维持神经发育关键基因的剪接保真性和表达稳定性至关重要,其缺失可通过破坏RNA加工导致小头畸形等神经表型。
该研究确立SNW1为原发性小头畸形的全新致病基因,其核心意义在于,从新生变异的临床鉴定,到体外功能缺陷的分子解析,再到动物与类器官模型的表型验证。这一结果或许不仅为SNW1相关疾病的临床诊断与遗传咨询提供了科学依据,更深化了对剪接体调控神经发育的理解,为未来开发靶向治疗策略奠定了理论基础。
上海交通大学Bio-X研究院吉雷博士、同济大学生命科学与技术学院研究生严瑾和美国犹他大学Nicole A.Losurdo博士为论文共同第一作者。湖南省妇幼保健院毛翛研究员、同济大学生命科学与技术学院边杉教授、上海交通大学Bio-X研究院贺光研究员为论文共同通讯作者。