生命科学与技术学院丁德强团队在《发育细胞》上发表文章揭示哺乳动物生殖颗粒的形成机制
来源:生命科学与技术学院
时间:2024-07-19 浏览:
生殖颗粒是特异性存在于动物生殖细胞的细胞质中的无膜细胞器(MLOs),参与多种RNA相关的代谢过程,包括小RNA加工、mRNA储存、mRNA翻译和降解等。在哺乳动物雄性生殖细胞中存在着一类位于线粒体簇之间的生殖颗粒,被称为intermitochondrial cement(IMC)。piRNA是一种在生殖细胞中特异性表达的小非编码RNA,与PIWI蛋白结合形成复合物通过抑制转座子、调节基因表达等机制促进精子发生的正常进行。IMC的组分中包含大量与piRNA生成有关的蛋白,因此IMC被认为是piRNA加工的主要场所。哺乳动物生殖细胞中IMC的形成对于piRNA生成以及精子发生至关重要,然而目前对于IMC的形成机制一直未知。研究表明,相分离(phase separation)通过生物大分子(包括蛋白质、RNA、DNA等)之间的多价相互作用形成大分子凝聚物,在细胞中促进多种无膜细胞器的形成。在果蝇、线虫以及斑马鱼的生殖细胞中,相分离参与多种生殖颗粒的组装。但是,相分离是否参与哺乳动物生殖颗粒的组装还不清楚。
7月18日,同济大学生命科学与技术学院/附属妇产科医院丁德强教授团队在《发育细胞》(Developmental Cell)上在线发表题为“TDRD1 phase separation drives intermitochondrial cement assembly to promote piRNA biogenesis and fertility”的文章。该研究揭示了TDRD1蛋白通过相分离活性驱动IMC组装的分子机制,并证明相分离驱动的IMC组装对于piRNA的生成、转座子沉默以及雄性生殖细胞发育至关重要。

已知TDRD1蛋白定位于雄性生殖细胞的IMC中,TDRD1缺失导致piRNA生成缺陷以及精子发生停滞。为了研究TDRD1蛋白的分子功能,研究人员首先借助荧光漂白恢复实验、细胞内融合与分离实验以及体外纯化蛋白的相分离实验证明TDRD1蛋白在细胞内和体外具有相分离活性。进一步研究发现TDRD1通过位于C端的coiled-coil超螺旋结构域自我相互作用,并自组装成四聚体来驱动相分离活性。通过一系列突变质粒的筛选,研究人员鉴定出coiled-coil结构域中的疏水氨基酸基序(1149ILLFLL1154)对于TDRD1的自我相互作用以及相分离活性至关重要。将疏水氨基酸基序突变后,TDRD1无法自我相互作用,从而失去相分离活性。除此之外,TDDR1蛋白包含4个串联的Tudor结构域。研究人员发现Tudor结构域通过识别对称精氨酸二甲基化修饰(sDMA)的蛋白,来促进TDRD1发生相分离。因此,TDRD1通过coiled-coil结构域的自组装以及Tudor-sDMA相互作用来获得多价相互作用,协同促进TDRD1相分离活性。
为了研究TDRD1相分离活性在生殖细胞中的生理功能,研究人员制作了TDRD1相分离活性缺失突变小鼠。研究人员将TDRD1蛋白C端coil-coil结构域中的疏水氨基酸基序ILLFLL突变成GSGSGS,使得TDRD1蛋白在生殖细胞中失去相分离活性。TDRD1相分离活性缺失突变小鼠雄性不育,其精子发生停滞在减数分离前期,无法产生成熟精子。进一步研究发现TDRD1相分离活性缺失导致IMC无法组装,piRNA生成量显著下降,转座子异常激活。这些结果证明了TDRD1相分离对于雄性生殖细胞中IMC的组装以及功能发挥至关重要。
最后,研究人员发现TDRD1的相分离活性在脊椎动物中具有很强的保守性,而在非脊椎动物中并不保守。进一步研究发现非脊椎动物的TDRD1同源蛋白缺少C端coiled-coil结构域,因此无法发挥相分离的活性。研究人员的这一发现解释了为什么IMC在脊椎动物生殖细胞中普遍存在,而在非脊椎动物生殖细胞中却并不显著。
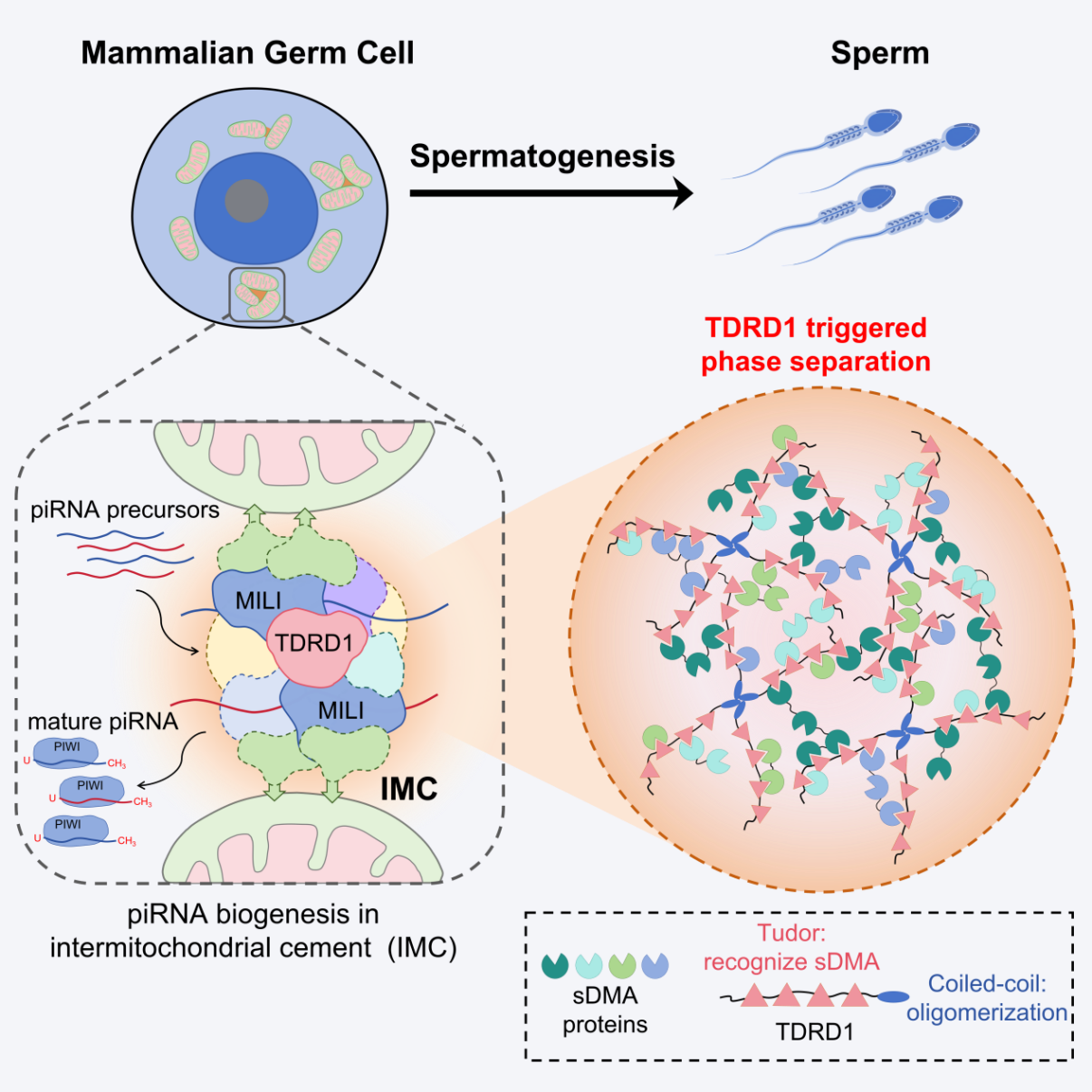
TDRD1蛋白通过相分离驱动IMC组装进而促进piRNA生物发生的分子机制
综上所述,该研究揭示了TDRD1相分离活性的分子机制以及TDRD1相分离活性在生殖细胞中的IMC组装、piRNA生成和转座子沉默中的生理作用。该研究将相分离与哺乳动物生殖颗粒的组装联系起来,为研究生殖细胞中无膜细胞器的形成以及功能发挥提供了新的思路,对于进一步理解哺乳动物精子发生的调控机制具有重要意义。
同济大学生命科学与技术学院博士生高洁、博士后景炅婕和博士生尚冠伊为该论文共同第一作者,同济大学生命科学与技术学院/附属妇产科医院丁德强教授为论文通讯作者。该项工作还得到了同济大学生命科学与技术学院陈坤教授、中国农业大学张拓副教授以及美国密歇根州立大学Chen Chen教授的大力支持和帮助。该研究得到了科技部、国家自然基金委以及上海市科委项目的资助。
论文链接:https://doi.org/10.1016/j.devcel.2024.06.017