附属同济医院杨长青团队发现药物性肝损伤的潜在治疗新靶点,相关研究成果发表于《肝病学杂志》
来源:附属同济医院
时间:2022-11-11 浏览:
肝损伤是众多肝脏疾病的起点,因此往往是肝脏领域突破性研究的发源地。药物性肝损伤(Drug-induced liver injury, DILI)是最常见的严重药物不良反应,也是全球目前导致急性肝衰竭的首要原因。近年来,随着中药、抗生素、抗肿瘤药物的广泛使用,中国内地的DILI疾病负担逐年增加,明显高于其他国家。因此,阐明DILI的核心发病机制,以寻找关键药物干预靶点具有重要的临床意义。
11月8日,同济大学附属同济医院消化内科杨长青教授团队在国际期刊《肝病学杂志》(Journal of Hepatology)以Original Article形式在线发表了题为“Hepatocyte-specific Mas activation enhances lipophagy and fatty acid oxidation to protect against acetaminophen-induced hepatotoxicity in mice”的论文,揭示了Mas信号在 DILI进程中的关键地位及核心机制,为药物干预新靶点的开发提供了重要的数据支持。

Mas是由新发现的原癌基因Mas1编码的G蛋白偶联受体,本身具备作为理想的药物干预靶点的属性。Mas在人和小鼠的多种组织内广泛表达,其天然配体为血管紧张素(1-7),后者是“抗炎型”肾素-血管紧张素系统的重要效应分子,因此理论上,激活Mas可能具有改善脂质代谢紊乱、抗炎、抗氧化等多重有益效应,但目前尚无研究涉及Mas在DILI进程中的作用。杨长青教授团队首先在DILI患者的肝脏局部检测到Mas表达水平的显著上调。多重荧光免疫组化染色显示,Mas在肝细胞呈低水平表达,且在髓系来源单核-巨噬及中性粒细胞呈高水平表达。研究者紧接着开展了一系列的功能实验,证实了DILI进程中肝细胞的Mas表达上调是机体应对肝损伤的一种保护性反馈,但尚不足以完全对抗药物引起的肝损伤。
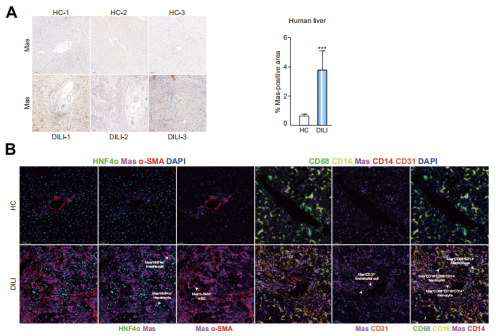
图1、DILI患者肝内的Mas表达模式
解热镇痛类药物——对乙酰氨基酚(acetaminophen, APAP)引起的DILI(以下简称AILI)是引起急性肝衰竭的主要致病药物之一。鉴于小鼠AILI模型可高度复刻人类AILI的病理生理机制,因此在DILI的研究领域中使用最为广泛。在本研究中,研究人员首先发现全身性、肝组织局部、肝细胞特异性Mas1基因敲除所致的小鼠AILI表型(包括肝损伤程度及炎症水平)高度类似,有力证实了肝细胞Mas信号在小鼠AILI进程中的关键地位。此外,通过腹腔注射Mas受体特异性激动剂AVE0991,实现Mas受体的体内系统性激活,可有效预防和治疗小鼠AILI。
脂质自噬(简称脂噬)是一种特殊类型的自噬,可选择性地识别脂滴,并高效整合至自噬小体中,利用溶酶体的酶分解甘油三酯产生游离脂肪酸,为脂肪酸氧化(fatty acid oxidation, FAO)提供底物,后者是机体降低脂质毒性的重要代谢途径。研究者发现,在AILI小鼠模型中,Mas信号缺失往往伴随着脂噬和FAO两大效应通路的受损,而激活Mas则可显著上调脂噬和FAO的水平。通过转录组、蛋白质组、非靶向代谢组及靶向脂质组等多组学联合应用分析,研究者筛选出AKT-FOXO1信号分子通路是Mas调控AILI进程中脂噬和FAO变化的关键通路,并通过体内外实验严密论证。
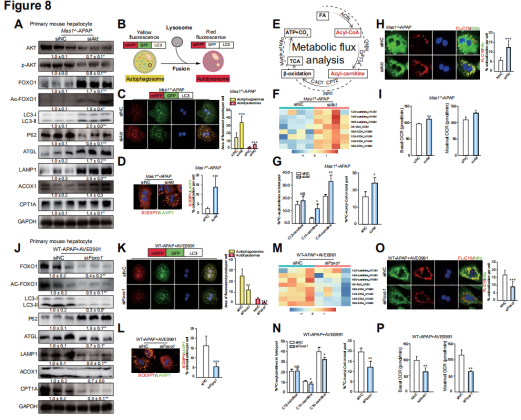
图2、Mas通过AKT和FOXO1信号分子调控APAP诱导的肝细胞损伤
为了更直观地展示Mas对炎症细胞的调控作用,研究者还利用清华大学脑与认知科学研究院开发的自适应扫描光场显微镜(digital adaptive optics scanning lightfield mutual iterative tomography, DAOSLIMIT),以超高时空分辨率生动呈现了急性AILI进程中,小鼠肝内中性粒细胞及单核巨噬细胞的运动轨迹。DAOSLIMIT技术大幅提升了活体三维成像的观测时长及时空分辨率,显著降低了光毒性,在国际上首次实现了哺乳动物活体内连续数小时的毫秒级高速持续观测,为揭示哺乳动物活体多细胞间的相互作用提供了全新路径,于2021年发表于著名学术期刊Cell。本研究所展示的数据,也是DAOSLIMIT在肝脏疾病研究中的首次应用。
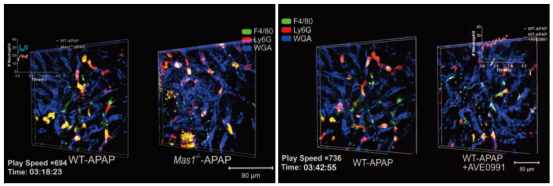
图3、DAOSLIMIT视野下Mas信号对中性粒及单核巨噬细胞的影响
上述研究发现在审稿阶段受到审稿人的高度评价,认为是AILI进程中的重大突破,可为未来AILI(对乙酰氨基酚导致的肝损伤)的治疗书写新愿景。
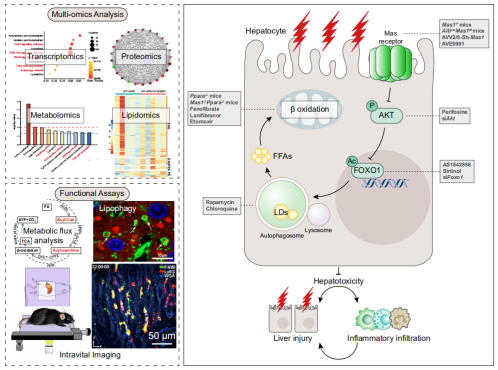
图4、研究方法及机制图总览
同济大学医学院博士生陈帅、清华大学自动化系博士生卢志、同济大学医学院博士生贾昊宇和杨博为论文的共同第一作者,同济大学附属同济医院消化内科杨长青教授和李婧副教授为共同通讯作者。陈帅、贾昊宇和杨博均是杨长青教授的在读博士。同济大学附属同济医院为论文的第一及通讯作者单位。清华大学脑与认知科学研究院为研究提供了重要的技术支持。该研究获得国家自然科学基金重点项目、上海市卫健委“展两翼”重点学科建设项目及上海市科委自然科学基金原创探索类项目等的支持。以前述研究结果为线索和基础,杨长青教授团队今年申报并获批了国家自然科学基金重点项目,为后续更深入地探究Mas在多种肝脏疾病中的作用提供了可能。(杨长青)