全球阿尔法核素靶向治疗(TAT)市场近年保持高速增长,欧盟各国、美国及日本等相继启动多项阿尔法核素(α核素)生产与药物研发计划,国内产业链也在快速布局223Ra、225Ac、211At、212Pb等关键α核药转化平台。然而,这一产业高速增长的背后,仍存在由于核素自身特性所带来的发展困境:核药精准递送体系匮乏、辐射生物机制图谱未明、α辐射剂量评估不准等。破解上述难题不仅是科学问题,更是关系到α核药产业格局与未来临床转化的战略性问题。
其中,镭-223(223Ra)是最早进入临床并获批用于治疗的α核素,其凭借天然骨亲和性,在去势抵抗性前列腺癌骨转移中取得了明确疗效。然而,223Ra作为碱土金属,难以与生物载体进行稳定螯合,且其衰变链中4个α子核素(219Rn、215Po、211Pb、207Tl)具有显著反冲能量,极易从载体中“逃逸”,造成全身脱靶辐射毒性,严重制约了223Ra在非骨性实体瘤中的应用拓展。要真正释放α核药的临床价值,迫切需要新的递送模式、新的治疗机制认知、以及新的评价策略。
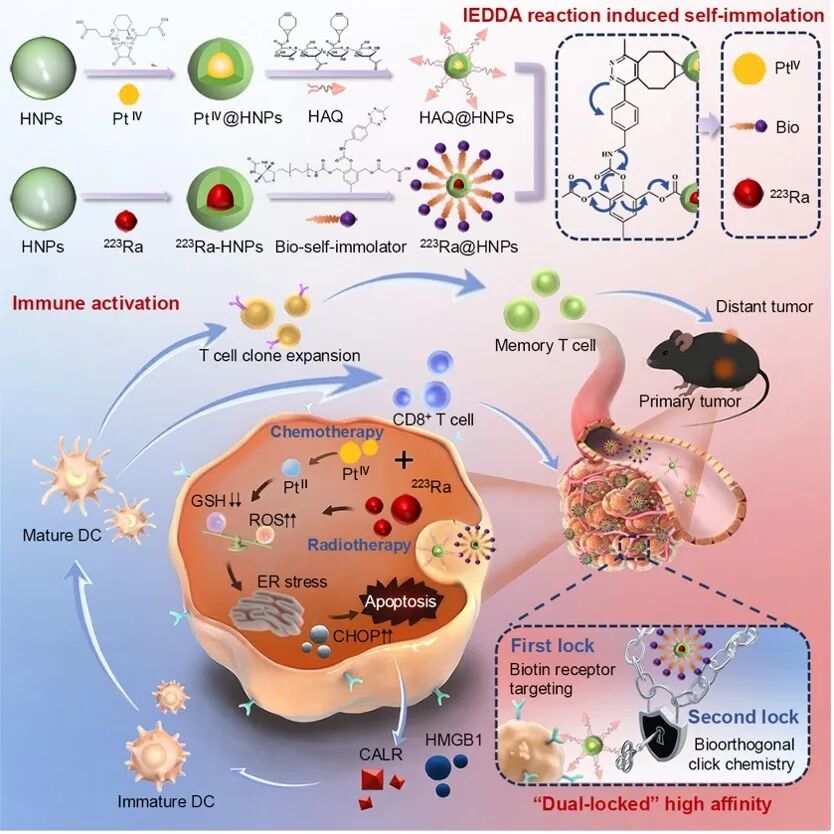
近日,同济大学核医学研究所余飞教授团队在《军事医学研究(英文)》(Military Medical Research)上发表题为“Dual-locked targeted alpha-emitter enhanced tumor immunotherapy via Diels–Alder reaction-based self-immolative molecular cage strategy”的论文。该研究利用逆电子需求狄尔斯-阿尔德(IEDDA)点击化学反应驱动的自裂解分子笼策略,实现223Ra肿瘤部位特异性“解锁”,并从内质网应激—免疫原性细胞死亡(ICD)—免疫检查点调控的路径解析其α辐射免疫效应,同时建立了初步剂量学框架,为新一代靶向α核药的设计与评价提供了可参考的技术路径。

自裂解分子笼双锁靶控223Ra:破解α核反冲并实现肿瘤高效富集
为破解α核素特有的“核反冲”难题,余飞教授团队在前期基于高原子序数金载体的物理缓冲的基础上,进一步从化学路径切入,构建了具有“双锁”靶控特征的223Ra递送体系。预靶向模块为携带环辛炔(BCN)基团的透明质酸修饰PtIV-水凝胶,主动靶向模块则为采用外接生物素的自裂解分子笼。后者中存在一个关键的“自焚壳”分子,其核心设计在于邻位苄基位置通过碳酸酯键对称连接了功能基团,分子的一端为四嗪基团,可与预靶向系统上的BCN发生高特异性的IEDDA反应;另一端则通过生物素实现肿瘤主动靶向。
IEDDA反应触发后,自裂解分子笼将发生电子级联驱动的1,4-消除反应,使分子骨架“自焚”,从而释放出被其“笼”住的核素药物。而在药物血液循环过程中,“化学开锁”通路始终保持关闭,且PEG高分子扩散阻隔作用构成稳定屏障,可抑制223Ra及其高反冲子核素的早期释放与泄露。此外,生物素主动靶向与IEDDA介导的肿瘤原位点击协同构成“双锁”机制,提升药物在肿瘤部位的富集效率。
该基于“双锁”靶控特征的自裂解分子笼策略,为223Ra构筑了仅在肿瘤区域“开门”的缓冲腔体,使核素在分子笼结构中获得更强的空间限域与化学束缚,有望降低反冲导致的逸散风险,并为兼具精准靶向与子核素束缚提供了可推广的化学工程化方案。
阐释亚细胞尺度辐射生物效应:阿尔法辐射免疫疗法(ARIT)
该团队在长期探索α粒子诱导抗肿瘤免疫效应的基础上,将研究尺度进一步拓展至亚细胞水平。本研究指出在高能α辐射作用下,内质网是早期发生损伤的关键细胞器,其所触发的应激反应与氧化还原失衡共同构成α辐射驱动免疫重塑的重要分子节点。α辐射诱导的内质网应激通过未折叠蛋白反应(UPR)途径,强化细胞应激负荷,进而促进免疫原性细胞死亡信号的表达,增强树突状细胞成熟及后续的细胞毒性T细胞应答等。
与此同时,α辐射诱导的内质网应激还伴随PD-L1上调,揭示了α辐射在免疫激活与免疫抑制之间的动态调节特性。这一特征表明α粒子的效应不止于直接造成DNA或细胞器损伤,更涉及精细的免疫网络调控,使其与免疫检查点抑制剂的联合能够形成机制互补的协同效应,为α核素与免疫治疗的组合路径提供理论依据。
余飞教授团队基于对α核素免疫调控机制的系统阐明,首次提出“阿尔法辐射免疫疗法(α-radiation immunotherapy, ARIT)”概念:即α粒子不再仅被视为高LET辐射的“纯物理杀伤”工具,而被定位为能够主动重塑肿瘤免疫微环境的“免疫调控开关”,为构建α核素与免疫治疗协同策略提供了明确的理论支点,并为未来TAT的系统性优化与组合方案奠定了新的概念基础。
建立阿尔法核药的剂量学框架:迈向可定量的α核素靶向治疗
该研究采用数字放射自显影技术直观揭示肿瘤内α粒子的空间分布差异,为理解微剂量沉积分布的异质性提供了直接证据。在前期核药研发与机制探索的基础上,研究进一步建立了223Ra核药的初步剂量学分析流程:通过多时间点生物分布实验获取体内活度随时间变化的数据,并利用MATLAB对时间—活度曲线进行多参数拟合,以定量描述核药动力学过程。
考虑到目前公开剂量学工具与数据库多建立于仿真人类体模,缺乏针对小鼠核药递送场景的专用S-值,该研究采用软组织等效的简化假设,在MIRDcalc平台上完成主要器官的吸收剂量估算。尽管该研究仍属保守估算,但已迈出了将α核药纳入可量化剂量学体系的重要一步,使TAT的疗效评价从经验性观察过渡到数据驱动的剂量–效应关联。
这一研究体现了余飞教授团队在α核素研究中“递送策略→机制阐释→剂量评估”的系统性闭环,为后续基于Monte Carlo模型开展高精度α粒子微剂量学奠定了实验基础与边界条件,有助于模拟亚细胞尺度的能量沉积与靶点结构损伤过程。这一剂量学框架的建立,对推动TAT治疗朝向安全可控、可量化和可个体化方向发展具有重要应用价值。
论文链接:https://link.springer.com/article/10.1186/s40779-025-00673-5